La lepra es una enfermedad infecciosa cuyo tratamiento consiste en el esquema de poliquimioterapia (rifampicina, dapsona y clofazimina) que ha logrado disminuir su prevalencia mundial. A pesar del impacto positivo de esta terapia, su eficacia se encuentra en riesgo con la aparición de resistencia a los medicamentos. Estas preocupaciones han sugerido el desarrollo de una vacuna capaz de promover una respuesta inmune de larga duración para la eliminación de la lepra. El objetivo de este trabajo es realizar una revisión documental de los aspectos históricos de la inmunoterapia e inmunoprofilaxis en Venezuela y a nivel mundial, mencionando los avances en proteómica y genómica, las vacunas iniciales y las actualmente operativas en la enfermedad.
Palabras clave: Enfermedad de Hansen; Mycobacterium leprae; Vacuna; Inmunoterapia; Lep-VaxF1.
Leprosy is an infectious disease whose treatment consists of the polychemotherapy scheme (rifampin, dapsone and clofazimine) that has managed to decrease its worldwide prevalence. Despite the positive impact of this therapy, its efficacy is at risk with the appearance of resistance to the drugs. These concerns have suggested the development of a vaccine capable of promoting a long-lasting immune response to the elimination of leprosy. The objective of this work is to carry out a documentary review of the historical aspects of immunotherapy and immunoprophylaxis in Venezuela and worldwide, mentioning the advances in proteomics and genomics, the initial vaccines and those currently operative in the disease.
Key words: Hansen's disease; Mycobacterium leprae; vaccine; Immunotherapy; Lep-VaxF1.
La lepra es una enfermedad infecciosa milenaria que genera un estigma en los pacientes que la padecen, debido a que causa afectación de la piel y nervios periféricos produciendo neuropatías y el desarrollo de discapacidades. En el año 1873, el Mycobacterium leprae (M. leprae) se identificó como agente etiológico causante de la enfermedad por el médico Gerhard Hansen (Zulueta et al., 1994). El tratamiento de elección por la Organización Mundial de la Salud (OMS o WHO) desde 1982 ha sido el esquema de poliquimioterapia supervisada (PQT) (combinación de rifampicina, clofazimina y dapsona) y es suministrado de manera gratuita (WHO, 2010). La eliminación de la lepra como problema de salud pública (prevalencia inferior a 1 por 10.000 habitantes) se logró en Venezuela gracias a la detección temprana de casos y al tratamiento PQT. Sin embargo en nuestro país actualmente persisten zonas hiperendémicas a nivel subregional. En el año 2016 se notificaron más de 200.000 casos a nivel mundial, entre ellos 12.819 nuevos casos con deformidades visibles clasificadas como discapacidad de grado 2. La incidencia de nuevos casos está disminuyendo a un ritmo de aproximadamente un 3% al año (WHO, 2018). A pesar del impacto positivo que ha tenido la PQT sobre la prevalencia mundial de la lepra, con disminución de la transmisión de la enfermedad, esta enfermedad se mantiene cada año como lo demuestran los nuevos casos que aún se detectan en el mundo (Duthie et al., 2011; WHO, 2019). La eficacia PQT también desaparecerá con la aparición de resistencia a los medicamentos (Ji et al., 1997; Matsuoka et al., 2000; Cambau et al., 2018). Si bien la PQT sigue siendo efectiva en la mayoría de los casos, pueden ocurrir recaídas o reinfecciones. Aunque las tasas de reincidencia son generalmente bajas (~1%), en algunas zonas endémicas de lepra las tasas de recaída son inaceptablemente altas (Gelber et al., 2004; WHO, 2010). Investigadores han reportado cepas de M. leprae resistentes a la PQT (You et al., 2005; Williams et al., 2004). Los datos actuales proporcionados por el sistema de vigilancia para evaluar la fármacorresistencia de la lepra (liderado por la OMS en 18 países endémicos) han revelado que en el periodo 2009-2015 el 6,8% de las cepas de M. leprae tienen mutaciones relacionadas con la resistencia a los antibióticos de primera y segunda línea (Cambau et al., 2018). La aparición de la lepra resistente a los medicamentos podría tener consecuencias catastróficas, deshaciendo los esfuerzos de la campaña de la OMS y provocando un rebote de incidencia de la lepra. Estas preocupaciones, junto con las limitaciones actuales en las estrategias de control y tratamiento, sugieren el desarrollo de herramientas adicionales tales como el diseño de una vacuna capaz de promover una respuesta inmune de larga duración para la eliminación de la lepra (Duthie et al., 2011). El objetivo de esta revisión se centra en describir los aspectos históricos de la inmunoterapia e inmunoprofilaxis en Venezuela y a nivel mundial, mencionando los avances en proteómica y genómica, las vacunas iniciales y las actualmente operativas en la enfermedad.
En Venezuela, el programa de control de la lepra se desarrolla desde el año 1946 (Zulueta et al., 1994). Hasta la actualidad, el diagnóstico precoz y el tratamiento con PQT siguen siendo el pilar principal para poder disminuir la carga bacteriana de esta enfermedad. Se estima que existe un retardo diagnóstico desde el momento del contagio, hasta la presencia del primer signo clínico perceptible de 1-3 años en más del 50% de los pacientes (De Rojas et al., 1994). Tales retrasos pueden tener un impacto negativo sobre el deterioro de la función nerviosa y la respuesta al tratamiento (Van Veen et al., 2006), surgiendo la necesidad de una vacuna eficaz con potencial tanto para uso profiláctico como terapéutico. Una vacuna a diferencia del tratamiento de drogas, podría ser utilizada para proporcionar una protección activa y sostenida tanto en individuos infectados como en no infectados.
La vacuna es una preparación destinada a generar inmunidad contra una enfermedad estimulando la producción de anticuerpos protectores. Dependiendo de su conformación se pueden dividir en dos categorías principales: vacunas vivas (utiliza organismos atenuados en vivo), y no vivas (agentes patógenos enteros muertos o componentes de ellos, o subunidades) (Capecchi et al., 2004). La inmunoterapia, permite estimular el sistema inmunitario frente a una patología. Las vacunas tienen utilidad profiláctica y/o terapéutica. La OMS ha implementado en la terapéutica contra la lepra inmunizar a los individuos con Bacilo de Calmette-Guerin (BCG) (WHO, 2019). La presencia de una cicatriz de BCG ha sido reconocida como un factor protector para la lepra (Goulart et al., 2008). El impacto de la vacunación con BCG en la lepra a menudo se pasa por alto, ya que las campañas de vacunación generalizadas han coincidido con la campaña de la OMS-PQT (WHO, 2018). El grado de protección contra la lepra que ofrece la vacuna BCG, ha variado dramáticamente entre los estudios, es más alta en los individuos más jóvenes y disminuye con el tiempo. Los metaanálisis sistemáticos indican una eficacia protectora general de 26 a 41% en estudios experimentales frente a 61% en estudios observacionales (Merle et al., 2010). Debido a su utilidad terapéutica para potenciar la respuesta inmune, y conociendo el defecto inmunológico en los pacientes lepromatosos, Convit et al. desarrollaron una vacuna con capacidad de estimular el sistema inmunológico formada por la combinación de M. leprae muerta por calor y BCG, la cual ya había demostrado cierto grado de protección contra la enfermedad (Convit et al., 1982; Aranzazu et al., 1984; Aranzazu et al., 1994).
Después del descubrimiento del bacilo de Hansen, los leprólogos empezaron a hacerse una serie de preguntas en relación con la patogenia de la enfermedad; ¿por qué razón solo algunos sujetos desarrollan la enfermedad? ¿por qué unos pacientes desarrollan una forma benigna y otros una maligna? De manera de dilucidar estas interrogantes incomprensibles para el momento, el profesor Mitsuda Kensuke, científico japonés elaboró en 1916 una suspensión de bacilos obtenidos de lepromas humanos, esterilizados a altas temperaturas, al cual se le adicionó ácido fénico. El filtrado de esta suspensión se llamó lepromina (Mitsuda, 1916). A numerosos pacientes con lepra y a sujetos sanos se les inyectaba 0,1 mL de lepromina por vía intradérmica en la cara anterior del antebrazo o del muslo. A los 20 o 30 días se examinaba la respuesta a la prueba y se encontraron los siguientes resultados: un primer grupo (1) de pacientes presentó una reacción Mitsuda negativa, sin ninguna reacción de eritema o de edema en el sitio inyectado, la respuesta era muy débil; el segundo grupo (2) daba una reacción ligeramente positiva, con reacción eritematosa, edematosa entre 10 mm - 15 mm y el tercer grupo (3) dio resultados fuertemente positivos mayores de 15 mm. Los pacientes del grupo 1 (el 20 a 30%) mostraban que tenían una reacción de defensa muy deficiente hacia el bacilo de Hansen, desarrollando formas más severas de la enfermedad, con gran número de bacilos (multibacilares), compromiso no solo de la piel, sino también de algunas vísceras. Los pacientes de los grupos 2 y 3 (el 70 a 80%) mostraban mejores defensas contra la enfermedad; presentaban menor número de bacilos (paucibacilares) y la evolución de la enfermedad de carácter más benigna. Las diferentes formas clínicas de la lepra son el resultado de la interacción huéspedparásito y están dadas por la presencia o ausencia de la respuesta celular ante el M. leprae. En Venezuela, como en otras partes del mundo, se ha demostrado que sólo un pequeño porcentaje de la población general es incapaz de reconocer específicamente al M. leprae. De este grupo se derivarían las formas difusas de la enfermedad, es decir la lepra lepromatosa y la borderline lepromatosa. El defecto específico reside en los mecanismos de defensa inmunológica y afecta tanto al macrófago como al linfocito T. El resto de la población, entre el 80 al 85% si es capaz de desencadenar los fenómenos de respuesta celular al entrar en contacto con el M. leprae. Este gran grupo es competente para eliminar totalmente el bacilo, permaneciendo sin evidencias clínicas de la enfermedad o puede dar formas benignas, limitadas; que corresponden al polo tuberculoide (Aranzazu et al., 1984). La demostración de un defecto inmunológico en las formas de lepra de baja resistencia (LL-BL-LI Mitsuda negativo), proporciona una base teórica firme para los ensayos de inmunoterapia en el tratamiento de esta enfermedad (Aranzazu et al., 1994).
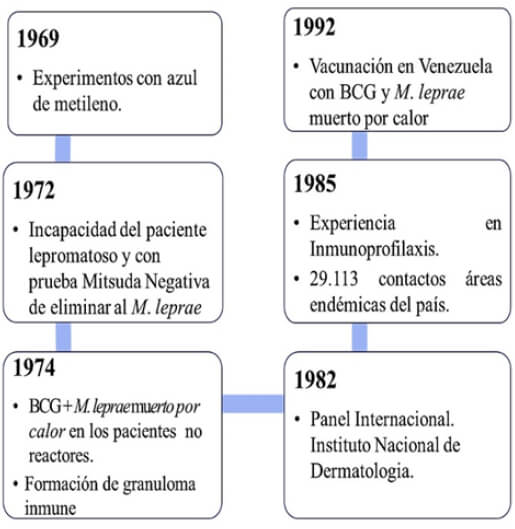
En 1969 Convit, Ávila y Goihman realizaron pruebas en pacientes con Hansen utilizando la tinción del azul de metileno. En dicho estudio se evidenciaba una coloración azul en las áreas afectadas de lepra lepromatosa luego de la inyección intravenosa del colorante, demostrando que los lípidos de membrana de la capa lipídica del M. leprae formaban complejos con el azul de metileno (Ávila et al., 1970). En consecuencia, buscaron áreas de piel sana en pacientes con lepra lepromatosa y tuberculoide, allí se inoculó M. leprae. Posteriormente se inyecto azul de metileno y se observó si el sitio de inoculación se teñía de azul (Goihman et al., 1972). Para sorpresa del grupo se encontró que las micobacterias en el paciente con lepra lepromatosa, LL permanecieron intactas, y en los pacientes con lepra tuberculoide, LT eran destruidas al cabo de 21 días (Ávila, 1996). Posteriormente en 1972, el mismo grupo de investigadores, al cual se incorpora María Eugenia Pinardi, desarrolló una prueba cutánea que permitió observar la incapacidad de la célula macrofágica frente al M. leprae, comparándola con la respuesta que dicha célula tiene frente a otras bacterias (Convit et al., 1972). En 1974 Convit et al. en un segundo enfoque se preguntaron cuál sería el comportamiento del macrófago hacia el M. leprae de una persona susceptible o de un enfermo lepromatoso, aplicando simultáneamente una mezcla de M. leprae más otra micobacteria (BCG) (Hanks et al., 1956). Se encontró que el macrófago activado por la segunda bacteria de la mezcla logró destruir y eliminar tanto al M. leprae como el BCG. Estos resultados sugieren que la mezcla de micobacterias provocaría la digestión del M. leprae y la liberación de alguno de sus antígenos, los cuales estimularían los linfocitos del sistema inmune en personas incapaces de realizar esta digestión (Ávila, 1996).
Posteriormente, una vez establecido el modelo que llevaba a la destrucción del M. leprae por personas susceptibles a la lepra, Convit et al., 1979-1983 realizaron nuevos estudios e intentaron determinar si los hallazgos antes mencionados tenían una influencia en grandes grupos de población, tanto en enfermos lepromatosos como en personas sanas susceptibles (contactos de pacientes que presentaron respuesta negativa a la lepromina). Esta etapa duro 10 años y mostró la capacidad de M. leprae + BCG para producir cambios inmunológicos en dichas personas con la consiguiente mejoría de su enfermedad (Convit et al., 1979).
Debido a la importancia de los hallazgos histopatológicos para la interpretación de los estudios de inmunoterapia, en diciembre de 1982 se llevó a cabo una experiencia en Caracas que consistió en un panel internacional de 6 histopatólogos expertos en lepra que examinarían a ciegas material histológico de pacientes antes y después de inmunoterapia. El grupo se reunió en el Instituto Nacional de Dermatología (Hoy en día Instituto de Biomedicina Dr. Jacinto Convit). Las observaciones de dichos expertos se analizaron para establecer los cambios histológicos a diferentes períodos de inmunoterapia. Se observaron cambios en la clasificación hacia el polo tuberculoide del espectro en un 90,5% de los pacientes inicialmente clasificados como lepromatosos y en 83,3% de aquellos inicialmente clasificados como borderline lepromatosos, BL (Convit et al., 1982). Este es uno de los estudios que galvaniza años de investigación del grupo de Convit en el sentido de la efectividad de la vacuna utilizada como inmunoterapia con fines terapéuticos y se decide realizar una experiencia de inmunoprofilaxis (Figura 1).
En el Instituto de Biomedicina, el Dr. Jacinto Convit ideó un modelo de vacunación como inmunoterapia de las formas LL-BL-LI Mitsuda negativo, y además en contactos Mitsuda negativo (Inmunoprofilaxis) (Convit et al., 1972). La explicación inmunológica de la vacuna no estaba bien determinada; se podría alegar que en pacientes que no respondían a los antígenos de la lepra, al introducir el BCG como “portador inmunológico” las células T fueron capaces en desarrollar una buena respuesta inmunológica del tipo Th1 (Aranzazu et al., 1994). En cualquier caso, los resultados obtenidos proporcionaron evidencias de que esta vacuna utilizada por Convit tiene actividad terapéutica en pacientes anérgicos y que debería tener potencial inmunoprofiláctico en la población de contactos en regiones endémicas (Convit et al., 1972; Aranzazu et al., 1994). La vacuna utilizada estaba constituida por una mezcla de M. leprae purificado siguiendo el método de Draper, autoclavado a 121°C, durante 15 minutos, y ajustado a una concentración de 6 x 108 M. leprae por dosis, que se mezclaba con BCG liofilizado, y se administraba por vía intradérmica (Instituto Pasteur Francia). La dosis colocada del preparado variaba de acuerdo a la respuesta obtenida por la prueba tuberculinica (PPD) previamente colocada al paciente utilizando:
El número de dosis de inmunoterapia era por lo general: 10 dosis, intervalo entre las dosis de 12 semanas y se colocaban en un periodo aproximado de 30 meses en total. La vía de administración era intradérmica; 0,5 mL de la mezcla que se distribuían en tres sitios, en regiones deltoideas y parte alta del dorso. Las respuestas locales de la vacuna eran de la misma intensidad que las observadas en la aplicación de BCG solamente y la cicatriz residual varíaba entre 5 y 9 mm (Aranzazu et al., 1994). Los resultados reportados demostraron la eficacia de la mezcla M. leprae y BCG en inducir cambios inmunológicos en las formas de lepra de baja resistencia, así como en contactos Mitsuda negativos. Tal como se desprende de las observaciones preliminares los resultados fueron, la remisión de las lesiones en los casos de lepra indeterminada y persistente con positivización a la reacción de Mitsuda (Convit et al., 1976).
La experiencia con la vacuna diseñada por Convit fue realizada en los estados hiperendémicos de Apure, Táchira y Mérida. En un intento por identificar una vacuna contra la lepra que ofreciera una protección mayor y más consistente que la BCG, se evaluó el potencial de vacunas de M. leprae y otras micobacterias en varios ensayos.
Convit y sus colegas entre 1983 - 1991 compararon la eficacia de BCG con y sin M. leprae en ensayos sobre 29.113 contactos procedentes de zonas endémicas de lepra en Venezuela (Figura 2); no se encontró evidencia en los primeros 5 años de seguimiento de que el BCG más M. leprae ofreciera mejor protección contra la lepra que la aplicación de BCG solo (Convit et al., 1992). Entre 1986 y 1989, el Grupo de Ensayos de Prevención de Karonga (norte de Malawi), evaluó la protección brindada por la vacunación con BCG vs BCG / M. leprae muerto por calor. Se encontró que, una dosis de la vacuna BCG ofrece más del 50% de protección contra la lepra. Al igual que en el ensayo venezolano, no se encontró que la vacuna BCG / M. leprae mejorara la protección contra la enfermedad (Karonga, 1996). Gupte y col, entre principios de 1991 y 1993, en el sur de la India llevaron a cabo un ensayo similar, con una población de 171.400 voluntarios. Realizaron un ensayo doble ciego, aleatoreo y profiláctico utilizando cuatro preparaciones de vacunas potenciales contra la lepra (BCG solo; BCG/M. leprae muerta; Mycobacterium welchii (Mw) y la cepa referente micobacteriana del complejo M. intracelulare CICR). En dos encuestas realizadas en los 8 años posteriores a la inmunización, se determinó que la protección conferida por BCG/M. leprae fue de 64%, y CICR de un 65.5% (Gupte et al., 1998). Por lo tanto, a diferencia de los ensayos anteriores en Venezuela y Malawi, el ensayo del sur de la India indicó que la vacuna BCG/M. leprae, y también la vacuna del CICR, cumplían los requisitos de los servicios públicos de salud y podrían implementarse para controlar la lepra (Duthie et al., 2011).
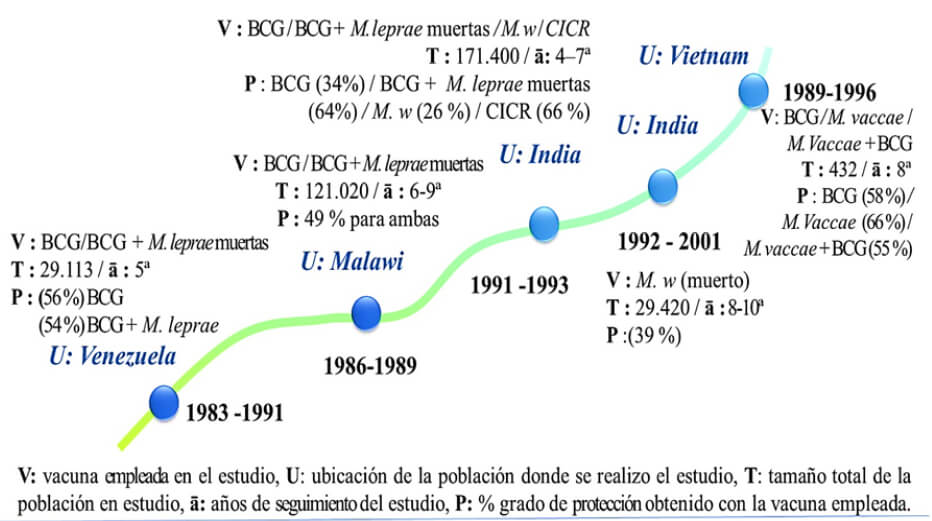
En el mundo se comenzaron a realizar los estudios inmunoprofilácticos antes mencionados en países endémicos de lepra incorporando distintas micobacterias (Mw, M. vaccae) para evaluar la respuesta protectora ante la enfermedad (Truoc et al., 2001) (Figura 2). En todos estos estudios realizados no se evidenció que otra vacuna compuesta por una micobacteria sola, ni mezclada con BCG mejorara la protección otorgada por BCG solo. La estrategia basada en una vacuna con M. leprae se limitó por la dificultad asociada con la ampliación de la producción, debido a que M. leprae no puede ser cultivado en laboratorio, y por lo tanto era necesario idear una vacuna formada de una subunidad de M. leprae. El enfoque convencional para el desarrollo de vacunas basado en el cultivo del microorganismo en condiciones de laboratorio a partir del cual se aíslan individualmente los componentes del patógeno mediante el uso de métodos bioquímicos, inmunológicos y microbiológicos no es aplicable a microorganismos no cultivables en este caso el M. leprae, por ello han surgido nuevas generaciones de vacunas en lepra.
Con el advenimiento de las técnicas de biología molecular y microbiología moderna, así como el aumento del conocimiento de la patogénesis de muchas bacterias, se exhibió la primera innovación importante en el campo de las vacunas. Este enfoque dio lugar a la producción de vacunas de subunidades basadas en antígenos protectores específicos. La era genómica ha cambiado por completo la manera de diseñar vacunas, partiendo de antígenos vía simulación computacional “in silico”. Estas técnicas informáticas son particularmente atractivas, porque son extremadamente rápidas y rentables y se pueden aplicar incluso sin que el compuesto esté físicamente disponible, independientemente de su abundancia y sin la necesidad de crecer el patógeno in vitro (Capecchi et al., 2004). Los métodos “in silico” se usan para la predicción y validación de técnicas y estrategias actuales tales como la predicción de los efectos sobre la salud humana. Actualmente es posible determinar la secuencia completa del genoma de un patógeno bacteriano en muy pocos meses y a muy bajo costo. Este nuevo enfoque basado en el análisis de las secuencias del genoma mediante el uso de herramientas bioinformáticas permitió identificar antígenos candidatos al desarrollo de vacunas. Esta técnica se denominó “vacunología inversa” (Rappuoli, 2000; Rana et al., 2016).
Con la disponibilidad de secuencias genómicas, los adelantos logrados en las técnicas y los avances en la separación de proteínas utilizando técnicas bioquímicas de electroforesis en gel de poliacrilamida bidimensional (2D-gel) y posteriormente su análisis en espectrometría de masas ahora es posible separar, identificar y catalogar las proteínas expresadas en una célula bajo varias condiciones. Todo el conjunto de proteínas codificadas por el genoma se ha definido como “proteoma” (Grandi, 2001; Washburn et al., 2000). En el análisis del proteoma, se encuentra una mezcla de proteínas tales como preparaciones de membranas externas o lisadas de células enteras y se resuelve primero en sus componentes individuales mediante procedimientos de separación. Una vez separados, cada proteína se somete a digestión con una proteasa específica para generar fragmentos de péptidos discretos y las masas moleculares se pueden evaluar con precisión por espectroscopía de masas. El resultado experimental se compara entonces con los resultados teóricos esperados para la misma degradación específica de todas las proteínas predichas a partir de la secuencia del genoma. De esta manera, la proteína puede ser inequívocamente identificada como el producto de un gen específico. El análisis físico del proteoma permite la identificación de proteínas expresadas en un compartimiento particular o bajo diferentes condiciones de crecimiento. El análisis del proteoma del compartimento de la membrana celular es una forma más directa para identificar proteínas de superficies expuestas y por lo tanto candidatas a vacunas (Capecchi et al., 2004).
La secuencia completa del genoma de la cepa de M. leprae se obtuvo a partir del año 2001; reportando en su configuración 3.268,210 pares de bases (Cole et al., 2001). El análisis bioinformático descubrió 1.614 genes que codifican proteínas y otros 50 que codifican ARN estables. Estos comprenden solo el 49.5% del genoma con el resto ocupado por pseudogenes (Singh et al., 2011). Inicialmente se encontraron 1.116 pseudogenes (Cole et al., 2001), pero esto aumentó a 1.293 cuando otras secuencias del genoma estuvieron disponibles para su comparación (Gómez et al., 2007). Existen 165 genes aparentemente funcionales que no tienen ortólogo con M. tuberculosis, por lo tanto, son genes que codifican proteínas específicas para M. leprae, las cuales ofrecen un potencial como reactivos de inmunodiagnóstico específicos (Katoch et al., 2007; Akama et al., 2010; Singh et al., 2011). Con el análisis del M. leprae se encontraron una amplia variedad de proteínas secretoras y asociadas a la superficie (PSAS), como las lipoproteínas, las proteínas de membrana externa (PME) y las proteínas secretoras que pueden considerarse como las dianas antigénicas más prometedoras que actuarían como agentes de las vacunas (Rana et al., 2016). Muchas de las PSAS bacterianas liberadas en el entorno del huésped han sido estudiadas y se ha informado que juegan un papel importante en la obtención de vacunas potentes (Li et al., 2015; Rana et al., 2015). Las PME son componentes importantes de la pared celular de las micobacterias, pero hasta ahora apenas se han investigado en el género Mycobacterium sp (Mah et al., 2010; Rana et al., 2014). Del proteoma completo de M. leprae, se identificaron 17 lipoproteínas, 19 proteínas de membrana externa (PME), 11 Proteínas secretoras (PSAS) (Rana et al., 2016). De las 19 PME, 4 son esenciales para la supervivencia del M. leprae por lo que representan las dianas más expuestas que entran en contacto directo con el entorno del huésped. Estas proteínas se identificaron como potenciales para unirse a un amplio rango de alelos MHC I y MHC II. Once de las PME contienen epítopes para células B ejecutando una respuesta humoral por lo que también son candidatas importantes para la elaboración de vacunas. Estos hallazgos de reconocimiento de células B y células T con estas PME podrían contribuir a la defensa inmune del huésped contra la lepra (Rana et al., 2016).
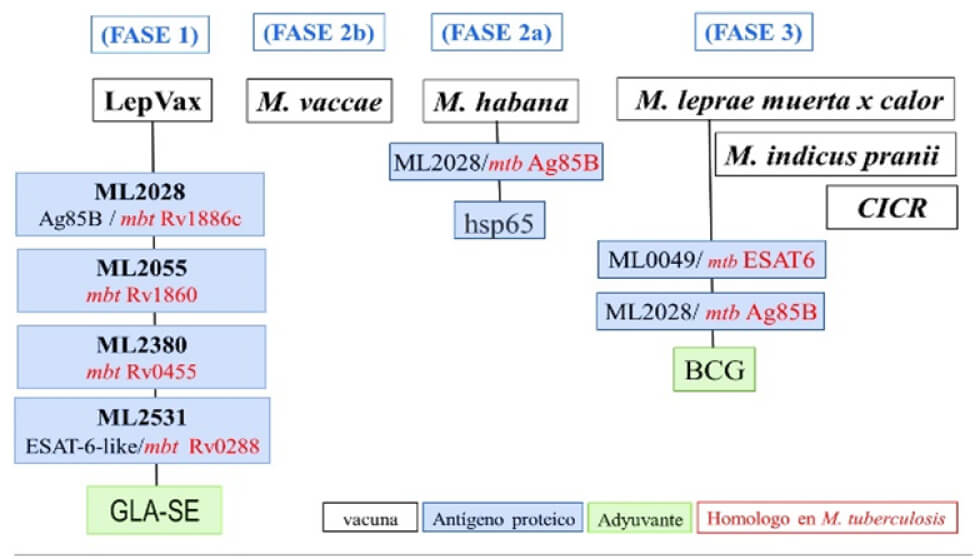
Mediante la secuencia completa del genoma del M. leprae, a través de marcos de lectura abierta putativos que solo se encontraron en el genoma de M. leprae y carecía de homólogos en cualquiera de las bases de datos bacterianas (myco) disponible en ese momento, se identificaron secuencias de 4 antígenos (hipotéticos). Estos se probaron por su capacidad para inducir respuestas in vitro de células T en individuos infectados por M. leprae (Figura 3) (Geluk et al., 2011). Entre los antígenos proteicos que han sido capaces de detectar respuestas de anticuerpos en la mayoría de los pacientes se incluyen ML2028 (pertenece al complejo 85B), ML2038 (bacterioferritina), ML2380 (proteína secretada), ML2531 (proteína de potencial virulencia, ESAT6) (Spencer et al., 2011). El Ag85B es una proteína altamente conservada entre las especies de micobacterias probablemente debido a su papel fundamental en la síntesis de la pared celular como una mycolyl transferasa. ESAT6 es una proteína secretora con virulencia restrictiva principalmente en el M. tuberculosis (Mtb) y organismos complejos (Figura 3). Ambas proteínas son ampliamente reconocidas por los anticuerpos en los enfermos de lepra multibacilar (Coppola et al., 2018). Puede ser posible diseñar una proteína de fusión que combine epítopos críticos de estas proteínas que son reconocidos por la mayoría de los casos de lepra paucibacilar para facilitar una mejor detección de la enfermedad (Geluk et al., 2011).
Para la elaboración de una vacuna es necesaria la utilización de un adyuvante; compuesto capaz de potenciar una respuesta inmunitaria (Mbow et al., 2010). La inmunidad innata forma la primera línea de defensa del huésped contra la invasión microbiana. Dirigirse a los receptores inmunes innatos con adyuvantes es una estrategia lógica para la terapéutica. Son muchos los tipos de adyuvantes que han sido utilizados en la creación de una vacuna. Se describe como adyuvante ideal, aquel compuesto capaz de aumentar la inmunogenicidad de una vacuna sin alterar desfavorablemente la seguridad del inmunógeno.
Los lipopolisacáridos (LPS) actualmente utilizados como adyuvantes en la elaboración de vacunas, son agonistas del receptor Toll like receptor 4 (TLR4). Es una molécula anfipática compleja que cubre la superficie externa de Escherichia coli (E. coli) y otras bacterias Gram negativas como M. tuberculosis. Fue el primer producto microbiano descubierto como agonista de TLR (Raman et al., 2012). Aunque el lípido A se había definido como el resto hidrofóbico de LPS durante más de 50 años, la aclaración de la biosíntesis del lípido A no se logró hasta principios de los años ochenta. La capacidad de la molécula del lípido A "libre" para inducir regresión tumoral, choque endotóxico, producción de interferón y activación de macrófagos generó mucho interés fisiopatológico (Takayama et al., 1983). La capacidad del TLR4 de utilizar las vías de señalización celular, del MyD88 (proteína de respuesta primaria de diferenciación mieloide 88) y TRIF (adaptador para responder a la activación de receptores tipo toll) han sido fundamentales para el éxito del lípido A como adyuvante. No está claro si una sola molécula TLR4 puede acceder a través de una o ambas rutas en ese momento, pero se ha sugerido que MyD88/MAL se requiere para la activación de TLR4 y para la producción de TNF. MyD88 activa el factor nuclear NF-κB, induciendo la producción de citocinas inflamatorias, mientras que la señalización a través de la vía TRIF / TRAM con los adaptadores, parece ser crucial para la producción de IL-6. Aún se requiere investigación adicional para definir los roles de estas dos vías de señalización en la activación de TLR4.
De los agonistas de TLR identificados, el Monofosforil Lipido A (MPL) es el más avanzado y actualmente es el único adyuvante con licencia disponible comercialmente en la actualidad. El adyuvante MPL ha demostrado ser un potente adyuvante de vacuna, pero aparentemente no tóxico cuando se administra con antígenos heterólogos. Con la finalidad de dividir sus efectos tóxicos de sus propiedades inmunomoduladoras se han identificado algunos derivados con potencial terapéutico. Estos son: el Monofosforil Lípido A (MPL) y Glucopiranosil Lípido A (GLA) que en una formulación de emulsión estable de aceite en agua (SE) ayudó a mejorar su eficacia (Raman et al., 2012). Varios estudios han demostrado que la inclusión de GLA-SE combinado con los biomarcadores específicos, induce una fuerte repuesta tipo Th1, con altos niveles de INF-γ, y con niveles comparativamente bajos de citocinas tipo Th2 como IL-4 e IL-10 (Figura 3) (Coler et al., 2011). Las inmunoglobulinas en suero también se vuelven sesgadas hacia una relación IgG1/ IgG2 más alta que al estar en presencia de GLA solo. Estudios demuestran que la respuesta a los adyuvantes es independiente de la dosis, orientando hacia una favorable respuesta tipo Th1 (Coler et al., 2018). El GLA-SE es un adyuvante más potente en comparación al MLP-SE en términos de estimulación de la activación de células presentadoras de antígenos y la mayor inducción de INF-γ por las células T. Las dosis bajas de GLA-SE son capaces de inducir una alta frecuencia de células T efectoras multifuncionales, por lo cual es el adyuvante ideal en la formación de estas nuevas vacunas (Figura 4) (Bertholet et al., 2009). Los efectos de la formulación sobre el antígeno de la vacuna y la eficacia del adyuvante siguen siendo críticos. Esperamos que el avance en el estudio de los adyuvantes de vacunas permita desarrollar un compuesto estable capaz de proporcionar una herramienta efectiva para controlar la enfermedad.
El desarrollo de una vacuna es un proceso largo y complejo que a menudo tarda de 10 a 15 años, e involucra la participación combinada de organizaciones públicas y privadas. Durante siglos, M. leprae, ha estado afectando a la humanidad independientemente del uso extensivo de antibióticos (PQT). Actualmente solo se han estudiado como probables vacunas ante la enfermedad de Hansen el M. leprae muerto por calor, el cual fue utilizado por primera vez en Venezuela por el Dr. Jacinto Convit, sirviendo de base para posteriores estudios de vacunas contra la lepra, como Mycobacterium indicus pranii (anteriormente conocido como Mw), CICR, el M vaccae utilizado por primera vez en Vietnam y M. habana.
El Mycobacterium indicus pranii (MIP) es comercializado con el nombre Immuvac / Cadi-05 por Cadila Pharmaceuticals para su uso como terapia complementaria de la lepra (Talwar, 2014). Comparte antígenos no solo con M. leprae sino también con M. tuberculosis y se ha empleado con éxito en el tratamiento de pacientes con tuberculosis de “difícil tratamiento” (Figura 3) (Sharma et al., 2017). Ha demostrado una fuerte actividad inmunomoduladora en pacientes con lepra, tuberculosis, cáncer y en pacientes con verrugas genitales, donde su administración cambió la respuesta inmune del huésped hacia el tipo Th1. MIP se ha utilizado como complemento del régimen estándar de PQT acelerando la eliminación de bacterias. También acorta el período de recuperación (Talwar, 2014), y elimina los granulomas, pero se han observado episodios reaccionales. Siguiendo los estudios de Talwar y col, utilizando MIP, se ha reportado la eliminación del bacilo en los nervios periféricos restaurando la sensibilidad normal (Talwar et al., 2017). Otros investigadores reportan que MIP tiene una eficacia protectora inducida por debajo de la de BCG (Coppola et al., 2018). A pesar de estos resultados, MIP se evaluó también en un segundo ensayo doble ciego a gran escala con 9 años de seguimiento. En este estudio, se observó la eficacia protectora de MIP en contactos domésticos durante un periodo de seguimiento de 3 años. La protección reportada contra la lepra (68%) fue la más alta para una vacuna que no sea BCG. Sin embargo, su efecto protector disminuyó considerablemente después de 6 años (60%) y a los 9 años (28%) (Sharma et al., 2005). A pesar de estos resultados contradictorios, MIP está siendo evaluado actualmente tanto como vacuna profiláctica como terapéutica contra la lepra en dos zonas hiperendémicas de la India, en combinación con una dosis única de rifampicina (Coppola et al., 2018). Además, se planteó administrar 2 dosis de la vacuna MIP a intervalos de 6 meses en familiares y contactos de los pacientes, proyecto que inicio en mayo 2017 inicialmente en 5 distritos de alta endemicidad en la India y se extenderá́ a otros distritos en función de la eficacia observada con esta vacuna (Talwar et al., 2017).
En el trayecto de investigación sobre una vacuna para la lepra han surgido muchas vacunas, entre estas M. vaccae que actualmente se encuentra en fase 2b, M. habana fase 2a, CICR y M. leprae muerta por calor que están en fase 3 (Figura 3) (Coppola et al., 2018). Estas nuevas vacunas se están desarrollando para reemplazar o aumentar el efecto protector de la BCG, con ventaja sobre ella y pueden también ser utilizados con seguridad en individuos inmunocomprometidos. El M. vaccae aún se encuentra en evaluación por su habilidad para prevenir la lepra en pacientes o contactos de la India. El M. habana comparte epítopes similares o idénticos con el M. leprae como el Ag85B (Coppola et al., 2018). Aunque la eficacia de estas vacunas ha sido cuestionable no se ha limitado su uso, ya que éstas han demostrado una respuesta favorable en dichas poblaciones de estudio. La respuesta obtenida por estas vacunas ha sido geográfico-dependiente.
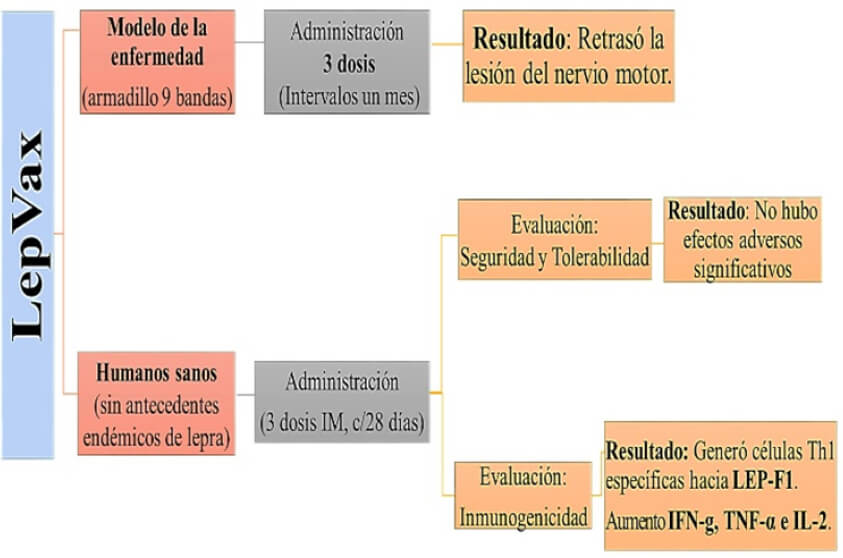
LepVax, es una vacuna de subunidad definida que comprende un conjunto de proteínas recombinantes que unen 4 Antigenos para M. leprae: ML2531, ML2380, ML2055 y ML2028, formulado con un adyuvante sintético Glucopiranosil Lípido A (GLA-SE) unido a una emulsión estable (Duthie et al., 2018). Los componentes antigénicos de LepVax o LEP-F1 fueron expresado por E. coli para luego ensamblar una proteína quimérica de fusión de 89kDa que consiste en el enlace en tándem de los cuatro antígenos de M. leprae mencionados anteriormente. LepVax produjo una respuesta Th1 específica y redujo significativamente la carga infecciosa (Duthie et al., 2018). Cuando se evaluó en armadillos de nueve bandas (modelo animal de enfermedad sintomática) se realizó un estudio profiláctico con la administración de 3 dosis de LepVax, a intervalos mensuales y en los resultados obtenidos se evidenció un retraso estadísticamente significativo en la lesión del nervio motor en comparación con la observada en los animales de control (Figura 4) (Duthie et al., 2018). Es importante destacar que la administración de una vacuna compuesta por subunidad específica contra la tuberculosis con el adyuvante similar (ID93 + GLASE) no retrasó ni alivió los déficits de la función nerviosa, lo que indica que la eficacia probablemente no esté mediada por la actividad de tipo adyuvante, sino más bien de una manera específica por el antígeno (Duthie et al., 2018).
El resultado beneficioso proporcionado por LepVax se contrapone directamente a la rápida y severa precipitación a la conducción nerviosa anormal que ocurrió en los armadillos que recibieron la inmunización con BCG después de la exposición con el bacilo. Los datos de dos evaluaciones independientes demostraron que el empleo de LepVax en armadillos era seguro y retrasó el daño neurológico causado por infección por M. leprae (Figura 4). Más recientemente, se inició en los Estados Unidos una evaluación de seguridad (Fase 1) en adultos sanos. Duthie et al., realizaron un ensayo donde se evaluó la seguridad y la inmunogenicidad de LepVax (LEP-F1 + GLA-SE). Para ello se reclutaron a sujetos sanos entre 18 y 55 años, sin antecedentes de viajes a un país endémico de lepra (Estados Unidos) con un objetivo principal de determinar la seguridad y tolerabilidad de dos dosis distintas recibidas de la vacuna candidata. El objetivo secundario fue evaluar la inmunogenicidad de la vacuna candidata mediante la evaluación de la durabilidad de las respuestas mediadas por células Th1 a la proteína Lep-F1 (Figura 4) (Duthie et al., 2019).
El primer grupo de tratamiento recibió LepVax vía intramuscular (IM), que constaba de una dosis 2 μg de LEP-F1. Cuando no se observó alteración a los 35 días, se aumentó a 10 μg LEP-F1 por inyección para el segundo grupo tratamiento, ambas dosis mezcladas con 5 μg de formulación con adyuvante GLA-SE. Los sujetos en ambos grupos de tratamiento recibieron un total de tres inyecciones IM en el deltoides (intervalo de 28 días), una inyección en cada uno de los días 0, 28 y 56. Para realizar la evaluación de la respuesta inmune, se recolectó sangre de cada sujeto mediante punción venosa al inicio del estudio: día 0, día 7, 35 y 63. Para determinar las respuestas de anticuerpos específicos anti-LEP-F1, se obtuvo el suero del paciente donde se midió el isotipo IgG. En el análisis de las respuestas celulares inducidas por la inmunización con LEP-F1 + GLA-SE se demostró que la producción de citocinas proinflamatorias tipo Th1 aumentaron después de la incubación con LEP-F1 (Figura 4) (Duthie et al., 2019). El ensayo presentado es la primera evaluación en humanos de una vacuna candidata contra la lepra creada a partir de subunidades.
Se estudiaron los efectos adversos asociados con LepVax, los cuales fueron generalmente leves, transitorios y típicos de las vacunas por inyección intramuscular. La mayoría de los sujetos reportaron algo de sensibilidad y/o dolor en el lugar de inyección (83,3%), ningún sujeto se retiró debido a un efecto adverso. Entre los efectos adversos de la inyección reportados durante el período de seguimiento después del estudio (día 85-421), no se informaron en este período acontecimientos adversos entre los sujetos y tampoco ocurrieron muertes durante el estudio (Authie et al., 2019). Para evaluar si existió una inmunización efectiva, Authie et al., recolectaron sangre para medir las respuestas de anticuerpos anti-LEP-F1 en el suero de los pacientes tratados. Se evidenció que LepVax provocó una fuerte producción de anticuerpos circulantes IgG específicos y generó células Th1 específicas hacia LEP-F1, con el aumento de la producción de IFN-γ, TNF-α e IL-2.
Por ello, tanto la dosis de 2 μg y 10 μg de la proteína LEP-F1, fueron seguras, bien toleradas e inmunogénicas (Duthie et al., 2019). Al evaluar la progresión en la escala de la dosis LEP-F1 de 2 μg y 10 μg en LepVax, se evidenció que no hubo alteración en la cinética de las respuestas de anticuerpos o citocinas específicas de antígeno, ni dio lugar a una mayor respuesta inmunológica. Estos datos sugieren que la dosis más baja del antígeno podría ser adecuada para estudios posteriores de eficacia, además se garantiza un mayor número de dosis disponibles de LEP-F1 (Duthie et al., 2019). Una explicación sugerida para ésto, en el contexto de la inmunogenicidad, es que una dosis de vacuna más alta, puede llevar a las células T a un estado de agotamiento con una menor avidez funcional y una mayor diferenciación a un estado terminal (Rhodes et al., 2019), lo que finalmente se traduce en una menor respuesta inmunológica.
Esta vacuna podría tener un impacto sobre la salud mundial sólo si se cumplen una serie de requisitos, los cuales incluyen una seguridad adecuada, eficacia, el suministro, la estabilidad y el costo. Para ello se realizarán evaluaciones futuras en regiones endémicas de lepra para evaluar los perfiles de seguridad y respuesta inmune del LepVax en una población de individuos asintomáticos y sintomáticos infectados por M. leprae. Por tanto, como una vacuna de subunidades LepVax puede ser producida a gran escala y a un costo suficientemente bajo para proporcionar una vacuna sostenible, es necesario realizar ensayos futuros que demuestren la eficacia de LepVax, y el grado de protección que esta pueda proporcionar frente a la enfermedad, y así convertirse en una estrategia mundial avalada por la OMS para el control de la lepra.
La creación de una vacuna para la enfermedad de la lepra ha sido un trabajo arduo y multidisciplinario desde el año 1983 cuando Convit y colaboradores comenzaron sus estudios con el BCG más el M. leprae completo muerto por calor. Han sido muchos los prototipos de vacunas utilizando distintas micobacterias: CIRC, M. vaccae, M. habana, M. leprae muerto por calor, sin ningún efecto protector contra la enfermedad mayor que el de la vacuna de BCG sola y generando un efecto protector debatible geoespecífico. El Mycobacterium indicus pranii (MIC) es utilizado actualmente como inmunoterapia en algunas zonas, pero su eficacia a futuro debe ser mejor evaluada. Gracias a los avances en genómica y proteómica ha sido posible idear una vacuna formada por una subunidad especifica de la bacteria que actúa estimulando la respuesta inmune en el paciente con lepra. Actualmente el LepVax ha sido la única vacuna creada según los avances en genómica que incluye todo el perfil tecnológico necesario. Esta es capaz de producir una respuesta Th1 reduciendo significativamente la carga infecciosa. Los resultados obtenidos en armadillos, modelo animal sintomático de la enfermedad han resultado satisfactorios ocasionando un retardo en el daño de la conducción nerviosa. Actualmente la vacuna LepVax se encuentra en sus primeras pruebas en seres humanos (fase 1) y hasta ahora estudios han demostrado que es segura entre individuos, sin efectos adversos graves. El impacto sostenido para la salud global solo ocurrirá si se logran cumplir varios requisitos, incluida la seguridad adecuada, la eficacia, adecuado suministro, consistencia y bajo costo. En el futuro solo con la búsqueda de una inmunoterapia eficaz, se garantizarán las herramientas complementarias necesarias para el control de la enfermedad.