La Lepra es una enfermedad infecciosa milenaria en donde existen avances importantes en el conocimiento del agente causal y en la elaboración de nuevos métodos diagnósticos para la enfermedad. Se realiza una revisión de los principales aspectos epidemiológicos, diagnósticos, de tratamientos utilizados y del papel del Instituto de Biomedicina en el manejo de la lepra en Venezuela.
Palabras clave: lepra; Venezuela; diagnóstico; tratamiento; epidemiología.
Leprosy is an ancient infectious disease where there are important advances in the knowledge of the causal agent and in the development of new diagnostic methods for the disease. A review of the main epidemiological, diagnostic and treatment aspects and the role of the Institute of Biomedicine in the management of leprosy in Venezuela is carried out.
Key words: leprosy; Venezuela; diagnosis; treatment; epidemiology
La lepra es una enfermedad infectocontagiosa crónica producida por el Mycobacterium leprae y Mycobacterium lepromatosis. Estas bacterias son intracelulares, ácido/alcohol resistentes con especial afinidad por las células de Schwann y el sistema retículoendotelial, y comprometen básicamente la piel, mucosas y nervios periféricos, pero pueden atacar otros órganos (Reyes, 2013). Es una patología infecciosa milenaria con evidencia arqueológica que ubica a la bacteria en seres humanos desde el Segundo Milenio antes de Cristo (Haas et al., 2000, Robbins et al., 2009), es por ello que es mencionada en textos como la Biblia, en el Atharva-Veda (libro sagrado de la India), entre otros. A pesar de su antigüedad, actualmente pertenece a las enfermedades olvidadas o desatendidas que tienen relevancia en la Salud Pública, en donde se invierten escasos recursos para el tratamiento. La Organización mundial de la salud (OMS o WHO) promueve fomentar su estudio para lograr la eliminación de la enfermedad, así como su estigma al comprometer no solo la salud sino la calidad de vida de los pacientes y sus familiares (Ovalles et al., 2010).
El origen de la lepra en América viene con la llegada de los conquistadores y el tráfico de esclavos desde África. El primer caso en Venezuela se ubica en el año 1626, en la persona de Don Pedro Gutiérrez de Lugo, Capitán General de la Provincia y posteriormente la enfermedad se fue diseminando. Esto motivó a la creación de Lazaretos o Leprocomios, centros en donde habitaban los pacientes con la enfermedad. Los principales se ubicaban en Cumaná (1750), Isla de la Providencia (1831) Ciudad Bolívar Angostura (1839), Barcelona (1846), Táchira (1874), y Cabo Blanco (litoral central 1906) (Zulueta, 1994). Dichos centros disponían de instalaciones hospitalarias y comunales (iglesia, cine, cárcel) y se puso a circular una moneda especial, el lazareto, todo de manera de que los enfermos estuvieran aislados.
Con el descubrimiento del bacilo productor de la enfermedad por Gerhard Henrik Armauer Hansen en el año 1873 comenzó la etapa científica de la lepra (Hansen, 1874). Este momento crucial cambió el enfoque de la patología pasando a ser una enfermedad infecciosa con posibilidad de tratamiento y erradicación. Es por ello que hoy la conocemos como enfermedad de Hansen.
La terapéutica de la lepra en el mundo ha pasado por varias fases que inician con la etapa de la incurabilidad, en donde se utilizaban diversos compuestos como grasa de pantera, aceite de Chaulmoogra, sales amoniacales, tintura de alcibar o mirra para las úlceras, termocauterio, radioterapia, sales de oro, entre otros, para el tratamiento de los síntomas. En 1941, tras el descubrimiento de las sulfonas, se inició la monoterapia para el tratamiento de la enfermedad. A partir de dicha fecha se emplearon diversos medicamentos como la dapsona (DDS), rifampìcina y clofazimina (Soucre et al., 2018). En el año 1946 se creó la división Venezolana de Lepra y se inició el tratamiento ambulatorio con DDS, permitiéndose la incorporación de los pacientes a la sociedad, con la posterior eliminación de los leprocomios. Comenzó la búsqueda activa de casos y el control de los contactos incrementándose la detección y prevalencia de la enfermedad. A partir del año 1956 comenzó el descenso gradual de los casos en Venezuela hasta alcanzar cifras estables (Zulueta, 1994). En 1972 se creó el Instituto de Dermatología hoy llamado Instituto de Biomedicina "Dr Jacinto Convit" en honor al Dr Convit, médico pionero en el estudio, tratamiento y control de la lepra. Dicha institución desde ese momento cumple funciones normativas, metodológicas, de investigación y docencia que se enfocan en el área dermatológica y en el desarrollo de programas sanitarios, en donde la lepra ocupa un lugar fundamental, bajo la supervisión del MPPS, de la Organización Panamericana para la salud (OPS) y de la OMS. Durante todo este proceso, la Universidad Central de Venezuela (UCV) ha jugado un papel fundamental, trabajando de manera coordinada en el área de investigación y docencia.
A partir del año 1981, debido a los problemas de resistencia a la monoterapia, la OMS inició el programa de terapia multidroga supervisada (rifampicina, DDS y clofazimina) que es el que se utiliza actualmente (WHO, 2018). La Institución trabaja en conjunto con los Servicios de Dermatología Sanitaria Regionales disponibles en casi todo el territorio nacional para garantizar el tratamiento a los pacientes. Durante todos estos años de historia se han ajustado los mecanismos para el control de la enfermedad. Actualmente la visión del programa a nivel mundial va dirigida a definir estrategias geográficas por grupos de trabajo, elaborar literatura de referencia, conocer la distribución de la enfermedad, caracterizar genómicamente al agente causal, poblaciones susceptibles, realizar el seguimiento de los casos y su tratamiento, además de elaborar nuevas técnicas de diagnóstico, puntos a los cuales nos referiremos a continuación.
En el Instituto de Biomedicina Dr. Jacinto Convit se realiza diariamente el descarte y tratamiento de casos, evaluación de contactos, se reportan los datos al MPPS y OMS y se imparte docencia al área de pregrado de la UCV y postgrado de Dermatología, Estomatología, Medicina interna del Hospital Vargas y la UCV, entre otros. Además es un centro de Formación para personal sanitario en lepra, que ha aportado a lo largo del tiempo datos importantes en el diagnóstico, tratamiento, conocimiento de aspectos epidemiológicos y fundamentos de la inmunoterapia (Convit et al., 1983), que a pesar de que no se utiliza actualmente ha permitido avances en la investigación de la enfermedad.
Tras el inicio de la poliquimioterapia (PQT), se ha evidenciado un descenso de la prevalencia mundial de la enfermedad. En 1997 Venezuela alcanzó los niveles de eliminación de la lepra a nivel nacional (< 1 caso por 10.000 habitantes (hab) (Convit et al., 1999). A nivel mundial para el año 2018 se reportaron 184.238 casos, con una prevalencia de 0,24 x 10.000 hab. En América se reportaron 30.957 casos nuevos, encontrándose la mayor incidencia en Brasil (93%) (WHO, 2019). A pesar de ello no se considera, a excepción de Brasil, un problema nacional de Salud Pública y pertenece a las enfermedades desatendidas.
Si evaluamos los datos a nivel subregional, la realidad es otra. Permanecen poblaciones hiperendémicas en zonas como los llanos, la Guaira y Miranda, por lo que actualmente se puede hablar de eliminación más no de erradicación de la enfermedad. La OMS busca disminuir los casos a < 1 caso por 10.000 hab a nivel subregional. Se establece como meta disminuir la discapacidad. Grado II (articulaciones rígidas, resorción ósea, pseudo amputaciones, deformidad visible, ceguera entre otros signos clínicos) en nuevos casos a menos de 1 por millón de hab, sin discapacidad en niños menores de 15 años con nuevo diagnóstico y sin discriminación para pacientes con Hansen. Dichas metas se resumen en la estrategia global para la lepra 2016-2020 (WHO, 2016).
Actualmente las tasas de detección de lepra se encuentran en descenso en Venezuela. Para el año 2018 se ubicaban a nivel nacional en 0,08 x 10.000 hab., siendo los estados más representativos Apure (0,45 x 10.000 hab) Portuguesa (0,39 x 10.000 hab) y Cojedes (0,36 x 10.000 hab) (Servicio Autónomo Instituto de Biomedicina (SAIB, 2018). Una de las posibles explicaciones a este hecho son la dificultad de acceso a los centros de atención por motivos económicos y de transporte, la disminución en la capacidad de penetración del personal de salud en las zonas de riesgo lo cual lleva a un subregistro y la migración, que es un fenómeno reciente detectado en la población con Hansen (Contreras et al., 2011). Para el año 2018 el 9% de los nuevos casos diagnosticados en el Instituto de Biomedicina solicitaron traslado a otros países para el seguimiento de su enfermedad. Venezuela representa el quinto país con más reportes de nuevos casos de lepra en América con 245 para el año 2018, luego de Brasil (28.660), Paraguay (345), Colombia (324) y Argentina (269). A pesar de ello somos el segundo país en prevalencia de casos en la región (con 790 casos) (WHO, 2019). Esto se debe a los índices de deserción y reinserción de los pacientes en el programa de lepra, lo cual hace que cumplan el tratamiento fuera del periodo recomendado por la OMS (18 meses) o requieran nuevos ciclos. Se realizan esfuerzos en la reinserción de dichos pacientes al tratamiento, para lograr la curación de la enfermedad. Es por ello que se propone una estrategia de control de poblaciones basada en la realización de censos, con convocatoria directa y examen clínico casa por casa con la colaboración de la población, así como la realización de campañas informativas de autoexamen de piel para detectar casos sospechosos y sensibilizar a la población con Hansen a que mantengan el tratamiento. Otra medida que se ha implementado en el Instituto de Biomedicina es la aplicación de los Sistemas de Información Geográficos, con herramientas online que nos permiten ubicar de manera espacial los nuevos casos para así implementar medidas de control en zonas particulares de mayor riesgo a nivel regional.
La forma clínica predominante en Venezuela para el año 2018 es la multibacilar (MB) (85,7%), y afecta en un 68% al sexo masculino, con un 3,2% de lepra infantil (menores de 15 años) y un 5,7% de discapacidad Grado II a nivel nacional (SAIB, 2018). Estos valores se corresponden a la literatura mundial, en donde predominan los casos MB, con menor afectación en mujeres (por factores desconocidos en donde se implican aspectos hormonales) y con menos casos en niños y ancianos. La presencia de casos en niños refleja la persistencia del bacilo en las comunidades, la transmisión activa y la exposición temprana al bacilo (Contreras et al., 2014) y el alto nivel de discapacidad puede ser explicado por un diagnóstico tardío. La lepra infantil presenta una epidemiología bimodal, con escasa presencia de fenómenos reaccionales. Existe un predominio de casos paucibacilares (PB) en menores de 10 años con predomio de los fenómenos reaccionales (FR) tipo I y con un comportamiento similar al adulto, en mayores de dicha edad prevaleciendo los FR tipo II (Cortés et al., 2004; Di Martino et al., 2011). Así mismo podemos evidenciar casos de neuritis subdiagnosticados lo cual lleva a discapacidad en dicho grupo etario, por lo que debemos enfocarnos en el descarte en contactos infantiles para lograr la meta de la OMS. En el Instituto de Biomedicina se reportaron un 33% de FR en niños, fenómeno que puede ser explicado por ser un centro de referencia de la enfermedad (SAIB, 2018).
Las tasas de curación promedio a nivel mundial se ubican por encima del 90%. En Venezuela para el año 2017 se encontraban en 66% en MB y 94% en PB (SAIB, 2018). Estos valores se deben a la optimización de registros de deserción de los pacientes del programa.
En las poblaciones hiperendémicas existe enfermedad subclínica y subregistro. Esto aunado a los largos periodos de incubación de la enfermedad, a los factores de riesgo y transmisión aún inciertos, a la potencial discapacidad que origina y a la inexistencia de una vacuna eficaz, mantiene el interés de la población médica en esta enfermedad. En estudios realizados por el Instituto de Biomedicina (IB) en poblaciones hiperendémicas se ha evidenciado un alto número de pacientes PB y lepra infantil (Aranzazu et al., 2012). En esas zonas, existe menor densidad de personal de salud calificado para el manejo de la enfermedad y existen niveles altos de inseguridad que dificultan el descarte activo de casos (Guevara et al., 2017).
Existe mayor prevalencia de casos en climas tropicales y subtropicales, con elevada temperatura y precipitaciones, con zonas deforestadas y de difícil acceso (Silva et al., 2010). La sobrevivencia del bacilo en el medio ambiente tropical, se estima en 36 horas o más (hasta 9 días). Además existen intermediarios en la transmisión, como son las amibas de vida libre, que permiten mayor supervivencia del bacilo en el ambiente (Lahiri et al., 2008). Han sido asociados como factores de riesgo de la enfermedad; la falta de agua, el baño en aguas estancadas, ríos, lagos o lagunas, la baja frecuencia de cambio de ropa de cama o hamaca (>bisemanal), las viviendas tipo rancho o casas rurales con ambientes oscuros y la mala disposición de excretas (aire libre, pozo séptico (Hegazy et al., 2002; Kerr-Pontes et al., 2006).
El principal reservorio del bacilo de Hansen es el ser humano. A pesar de ello se han involucrado otros animales tales como algunas especies de primates (Chimpancés, Monos Mangabeys, Cynomolgus macaques), ardillas y armadillos. En el caso particular del armadillo, su contacto directo se ha asociado con mayor riesgo de padecer enfermedad de Hansen (Odds ratio (OR) 2) (Deps et al., 2008; Truman et al., 2011). En Suramérica existe una relación espacial entre el hábitat del Dasypus sabanicola (cachicamo) y las zonas con mayor número de casos de la enfermedad, con detección serológica y molecular de M leprae en otras especies de armadillo en Brasil (da Silva et al., 2020), hecho que debe ser mejor investigado para aclarar su papel en la prevalencia de la enfermedad.
El mayor factor de riesgo de la enfermedad es la distancia espacial y temporal con el caso índice, lo cual se corresponde con la definición de contacto. El riesgo se incrementa con la cercanía con el caso índice de la siguiente manera: aquellos que viven bajo el mismo techo usando la misma cocina (OR 2,44); los que viven bajo techos separados compartiendo la misma cocina (OR 1,69) y los que viven bajo el mismo techo pero no usan la misma cocina (OR 1,05). El contacto de una persona por más de 6 horas al día por 6 meses con un caso no tratado de Hansen incrementa el riesgo de padecer lepra, en especial si éste es MB (Hegazy et al., 2002; Kerr-Pontes et al., 2006; Hoeven et al., 2008).
El bacilo de Hansen tiene un diámetro de 0,3 a 0,5 micras, longitud de 4 a 5 micras, esta curvado ligeramente en uno de los extremos y forma aglomerados (globis), lo cual le permite resistir los embates del sistema inmunológico. El bacilo presenta coloración Ziehl Neelsen (ZN+); y tiene un tiempo de duplicación entre 12 y 14 días. En razón del largo periodo de incubación es difícil el cultivo empleando métodos convencionales. En centros de investigación, el bacilo se mantiene en armadillos de 7, 8, 9 y 11 bandas (Aranzazu, 1994).
Desde el año 2000 se dispone de la secuenciación genómica completa del Mycobacterium (M) leprae y actualmente se reconoce al M lepromatosis como otra especie productora de lepra asociada con la forma difusa de Lucio y fenómenos de Lucio en México y Suramérica. Esta especie dispone de factores de patogenicidad incorporados por plásmidos que se asocian a mayor severidad de la enfermedad (Han et al., 2008; Singh et al., 2015). El descubrimiento de la genómica y proteómica de la bacteria ha abierto el camino al conocimiento de vías metabólicas, factores de patogenicidad, descubrimiento de antígenos y proteínas para elaborar pruebas diagnósticas e inmunoterapia.
A pesar de que las características del genoma del M. leprae son excepcionalmente bien conservadas y altamente clonales, tras los avances en biología molecular se han identificado a través del análisis de polimorfismos de nucleótidos simples (SNPs) 4 tipos de micobacterias productoras de Hansen y 16 subtipos, abriendo el campo del estudio molecular y filogenético del bacilo (Monot et al., 2009; Das et al., 2016). Esto podría explicar su origen, migración y algunas diferencias clínicas de la enfermedad.
Los subtipos de micobacterias productoras de lepra más comunes reportados en Sur América son el 3I (73.8%), 4P (11.6%), 1D (6.9%), 4N (6%), y 4O (1.7%). (Singh et al., 2011). El Instituto de Biomedicina y sus centros regionales de dermatología sanitaria han participado en la recolección de muestras para la caracterización genómica de las micobacterias productoras de lepra en Venezuela, a través de investigaciones realizadas en conjunto con el Dr Paniz-Mondolfi y sus grupos de trabajo y actualmente se participa en la recolección de muestras de casos de recidivas o de difícil diagnóstico para que, en conjunto con el laboratorio del Dr De Waards (IB), su equipo de investigadores y con ayuda internacional se continúe con la caracterización molecular de los tipos de bacilos productores de lepra, que circulan en el país, y se realice un potencial seguimiento de la resistencia bacteriana.
En cuanto a la caracterización genética de poblaciones, hoy en día se considera un punto fundamental para evaluar susceptibilidad genética individual y poblacional. Existen genes ubicados en el cromosoma 6 (6q25, 6q26), y polimorfismos en genes como el de "resistencia natural asociado a la proteína del macrófago-1" (NRAMP1) que se han asociado a susceptibilidad para la lepra, así como polimorfismos en los promotores para los genes del Factor de necrosis tumoral-α (TNF-α) , interleucina (IL) -12, IL-10 asociados a la enfermedad. Los alelos del antígeno leucocitario humano (HLA)-DR2 y DR3 se han asociado a lepra tuberculoide (OR 3,33) y HLA DQ1 a lepra lepromatosa (OR 5,4) (Lázaro et al., 2010; Mazini et al., 2016). Así mismo se han realizado los estudios de variantes de codificación de proteínas en poblaciones con lepra (Liu et al., 2017). De esta manera, partiendo de la proteína al gen, se puede realizar el análisis integrado de la red de genes de susceptibilidad a la lepra, se puede estudiar la participación de la inmunidad tanto innata como adaptativa y el papel del interferón gamma, la actividad del factor nuclear potenciador de las cadenas ligeras Kappa de las células B activadas" (NF-kappaB), filagrina, profilagrina (barrera cutánea), citoesqueleto (endocitosis fagocitosis), entre otros, en la enfermedad.
El diagnóstico de la lepra deberá soportarse con los criterios: clínicos, baciloscópicos, histopatológicos, inmunológicos y en ocasiones con apoyo de la electromiografía (Aranzazu, 1994; Reyes, 2013). Las pruebas de intradermorreacción como la lepromina y el antígeno soluble han caído en desuso por su poca disponibilidad al requerir de la micobacteria, que no es cultivable in vitro. La clave para el diagnóstico de lepra MB, en donde hay inadecuada respuesta celular (RC) con aumento en el número de bacterias y anticuerpos, viene dada por el estudio baciloscópico de piel y tejidos coloreados con Ziehl Neelsen (ZN) y la determinación de anticuerpos a través de pruebas serológicas. En lepra PB, en donde hay adecuada RC con poca formación de anticuerpos y escasas bacterias, el diagnóstico constituye un reto, para lo cual se propone la elaboración de nuevas pruebas intradérmicas estandarizadas a partir de componentes de la micobacterias, que pasen a sustituir a la lepromina. En situaciones de difícil diagnóstico se recomienda el análisis de los tejidos empleando pruebas de biología molecular y reacción en cadena de la polimerasa (PCR). A través de la amplificación del ácido desoxirribonucleico (ADN) y del ácido ribonucleico (ARN) se han logrado avances en el descarte de contactos, monitoreo del tratamiento, determinación de genes de resistencia a drogas, descarte de persistencia bacteriana y elaboración de guías de terapias dirigidas.
Se define como caso probable aquel paciente con al menos uno de los dos signos cardinales: (i) pérdida definitiva de la sensibilidad en un parche o mancha hipo pigmentada o rojiza de la piel; (ii) nervio periférico engrosado o agrandado con pérdida de la sensibilidad y/o debilidad de los músculos alimentados por ese nervio (WHO, 2018).
La OMS considera que la evidencia clínica de uno de estos signos puede sustentar el inicio del tratamiento siempre que el índice de sospecha sea alto, sea contacto de Hansen o provenga de zona hiperendèmica. A pesar de ello se recomienda tratar de confirmar el caso con la búsqueda de las bacterias.
Las formas clínicas dependen de la respuesta celular (RC) del individuo ante la penetración del M. leprae en el organismo, de tal manera que en la enfermedad de Hansen podemos encontrar un espectro de manifestaciones clínicas que van desde las formas localizadas hasta las diseminadas de la enfermedad.
Una de las clasificaciones más importantes es la clasificación inmunológica de Ridley y Jopling (Ridley et al., 1966), la cual correlaciona aspectos clínicos, histopatológicos e inmunológicos y clasifica a la lepra en un espectro que va desde la forma Indeterminada hasta la Lepromatosa (Figura 1).
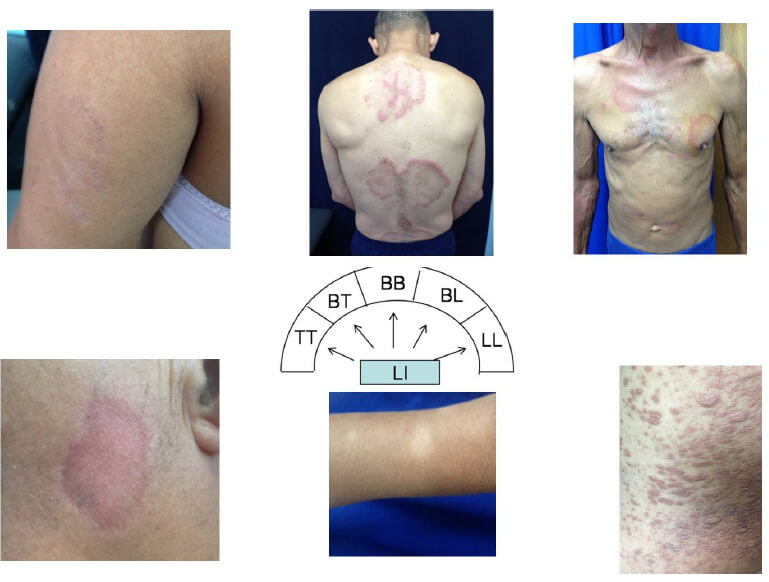
Se considera una forma de lepra de inicio en donde los fenómenos inmunológicos no se han definido y por lo tanto la forma clínica tampoco. Se caracteriza clínicamente por la presencia de una o pocas manchas hipo pigmentadas de pocos centímetros de diámetro, generalmente con márgenes mal definidos, trastornos sensitivos y test de histamina anormal. El cuadro histopatológico es un infiltrado inflamatorio linfohistiocitario perivascular, perineural y perianexial. Los bacilos, muy escasos, deben ser buscados exhaustivamente en los nervios y anexos, sobretodo en el músculo pilo erector. Los frotis de piel en sitios convencionales y en la lesión son generalmente negativos. Las pruebas RC tanto in vivo como in vitro, dan resultados variables.
Es la forma difusa debida a un defecto de RC, lo cual provoca una multiplicación exagerada de la bacteria y una invasión de la piel, tejido celular subcutáneo y todos los órganos internos excepto pulmón y cerebro. Clínicamente se observan lesiones variadas tales como: Infiltrado eritematoso difuso, generalizado, especialmente en la cara, puede haber ataque a los nervios periféricos con daño del nervio que se demuestra por anestesia de las manos, y pies. Se puede ver madarosis. Cuando hay presencia de infiltración difusa con eritema sin nódulos se denomina Lepra de Lucio. La lepra de Lucio se ha asociado principalmente al M lepromatosis, y puede llevar a fenómenos periféricos de necrosis en los pacientes. También podemos evidenciar formas clínicas donde predominan nódulos aislados o agrupados en placas de diferentes tamaños pigmentados, duros brillantes con predominio centro facial, con infiltración de pabellones auriculares y depresión en el dorso nasal. Existe invasión progresiva de las mucosas y del tracto respiratorio alto en un 80% de los pacientes, en ocasiones con rinorrea, obstrucción nasal hasta destrucción del hueso propio de la nariz. La laringe y el paladar pueden estar afectados. El ojo puede dar manifestaciones como: conjuntivitis, iridociclitis, uveítis, lagoftalmo, ceguera entre otras. Puede haber ginecomastia por atrofia testicular. El cuadro histológico se caracteriza por un infiltrado macrofágico difuso con la presencia de una banda de colágeno sub-epidérmica indemne. Los macrófagos tienen diferentes grados de vacuolización y están repletos de grandes masas de bacterias. Estas se pueden encontrar en todas las estructuras de la piel y fuera de los macrófagos. Los nervios están infiltrados, pero son reconocibles. La reacción de Mitsuda y el antígeno soluble son negativos y las pruebas in vitro de RC son negativas. Hay alta titulación de anticuerpos, principalmente contra el Glicolípido fenólico-1 (GLP-1). Los frotis de piel (linfas) para el bacilo ácido alcohol resistente (BAAR) son positivos entre 5 y 6+. Además existe otro subtipo de lepra lepromatosa denominada Lepra Histioide con características particulares a nivel histopatológico que la diferencian del resto de los pacientes lepromatosos, con presencia de histiocitos de morfología fusiforme.
Se presentan placas o máculas eritematosas, eritemato-pigmentadas o violáceas, de morfología anular y distribución bilateral, Puede haber hipoestesia o anestesia total sobre todo en el centro de las lesiones. El cuadro histológico se caracteriza por un granuloma macrofágico con diversos grados de vacuolización y presencia de escasos linfocitos. Coloración de Fite Faraco (FF) de 4 a 5+ con bacilos irregularmente distribuidos. Los frotis bacteriológicos de piel son positivos de 4 a 5+ para BAAR. La reacción de Mitsuda y el antígeno soluble son negativos. Las pruebas in vitro de RC son negativas. Se encuentra un alto título de anticuerpos contra el GLP-1.
Las lesiones son intermedias entre LL y Lepra Tuberculoide (LT). Placas rojizas o asalmonadas, ovales o redondas. La típica lesión BB es una placa de centro claro de un borde con infiltración variable, de contorno interno muy bien limitado y externo difuso. Puede haber anestesia variable sobre todo en el centro de la placa. El cuadro histopatológico presenta células epitelioides difusamente esparcidas en el granuloma sin células gigantes. Macrófagos indiferenciados. Los linfocitos pueden estar presentes, distribuidos irregularmente. Nervios infiltrados pero reconocibles. Frotis de piel para búsqueda de BAAR: 1 a 3+. La reacción de Mitsuda generalmente es negativa, pero en algunos casos pueden ser débilmente positivas. El antígeno soluble es negativo y las pruebas in vitro de RC son negativas. Los títulos de anticuerpos contra GLP1 son moderadamente positivos.
Presencia de máculas o placas en número variable, más o menos bien limitadas, asimétricas, rojizas, parduscas o hipocrómicas. Pueden ser elevadas en su superficie o con un centro claro. Los nervios periféricos son frecuentemente afectados. Los cortes histológicos demuestran un granuloma de células epitelioides focalizadas o rodeados de linfocitos con numerosas células gigantes. Los nervios y anexos están infiltrados, pero pueden ser reconocidos. En la coloración de F.F. se observa la presencia de bacilos escasos predominantemente en los nervios. Frotis bacteriológicos de piel para BAAR ligeramente positivos de 1 a 2+ o pueden ser negativos. Reacción de Mitsuda y antígeno soluble variadamente positivas. Pruebas in vitro de RC positivas. Los anticuerpos son débilmente positivos.
Las lesiones son generalmente únicas. Placas rojizas parduscas y en algunos casos hipocrómicas, redondeadas u ovales, de bordes bien definidos, generalmente de centro regresivo y anestésico. La piel en la lesión es seca, generalmente escamosa, alopécica y con anestesia marcada. El cuadro histológico se presenta como un denso granuloma formado por células epitelioides muy bien diferenciadas rodeadas por linfocitos o invadiendo éstos el granuloma. Hay presencia de células gigantes de tipo Langerhans. Los nervios y anexos están muy infiltrados y la mayoría de las veces son irreconocibles. A la coloración de F.F. no se encuentran bacilos o son muy escasos. Frotis bacteriológico de piel: negativo. Reacción de Mitsuda, antígeno soluble y pruebas in vitro de la RC positivas. Los anticuerpos contra GLP-1 son muy débiles o no se encuentran.
Es una forma de la enfermedad que se ve principalmente en zonas hiperendémicas y está caracterizada por el compromiso de los nervios periféricos en ausencia de signos cutáneos u otros signos sistémicos. Las alteraciones neurológicas son variables: neuropatía sensitiva o sensitivo motora, acompañada o no de alteraciones tróficas del territorio inervado, o de nervios palpables. Algunos autores consideran a este tipo de lepra para su clasificación dentro de las indeterminadas.
La micobacteria puede afectar cualquier órgano con sistema retículo-endotelial, excepto el cerebro y pulmón, y cuando esto ocurre sin manifestaciones predominantes en piel, puede dar origen a la lepra visceral.
La OMS utiliza una clasificación operativa de la lepra y la divide en MB y PB (WHO, 2016). Se considerarán pacientes PB aquellos que presenten menos de 5 lesiones clínicas sugestivas de Hansen, y a quienes no se le identifiquen por ningún método bacteriológico la presencia de bacilos (en linfas o biopsias de tejido). Se considerarán pacientes MB a aquellos con 5 o más lesiones clínicas sugestivas de Hansen, o que presenten afectación sensitiva o motora (neuritis pura, o cualquier número de lesiones cutáneas y neuritis) o aquellos a los que se le identifiquen bacilos con cualquier estudio bacteriológico (independientemente del número de lesiones).
Los pacientes con enfermedad de Hansen pueden presentar FR que corresponden a complicaciones inflamatorias que pueden aparecer, antes, durante o después del tratamiento antihanseniano. Existen 2 tipos:
Tipo I: ocurren principalmente en las formas borderline. La destrucción del bacilo produce eritema y edema de las lesiones preexistentes o la generación de nuevas lesiones. El estado general del paciente no se compromete y puede haber un grado variable de daño neural. Existen 2 formas de presentación: el fenómeno de reversión (que es el más usual) se caracteriza por una mejoría inmune que lleva a los pacientes hacia formas más paucibacilares de la enfermedad, con reducción de la carga bacilar; y los fenómenos de lepromatización en donde el paciente presenta un deterioro inmune que lo lleva a un incremento del índice bacilar.
Tipo II: están relacionadas con pacientes MB, en los cuales la respuesta celular está ausente o deprimida. Consiste en una reacción de hipersensibilidad tipo III. Las lesiones pueden ser esporádicas o convertirse en crónicas, extenderse e involucrar diferentes órganos persistiendo por muchos años. Existen varias formas de presentación: de los FR tipo II:
La OMS promueve la elaboración de nuevas pruebas diagnósticas que permitan el diagnóstico precoz, en especial en pacientes PB y contactos. La prueba ideal no existe actualmente. Se busca que sea de fácil aplicación, rápida, económica, poco invasiva y que pueda ser llevada a trabajos de campo en grandes poblaciones.
Se ha investigado el uso de marcadores lipídicos a través de improntas de piel (1 cm) en placas de silicona analizadas por espectrometría de masa, (ESIHRMS) en lepra (Lima et al., 2015), así como herramientas adicionales histopatológicas como son la inmuno histoquímica utilizando la proteína S100 como marcador de las células de Schwann de los nervios periféricos para facilitar la identificación del daño neural (Tirumalae et al., 2014). Además se ha utilizado el método de citología por punción con aguja fina de lesiones de pacientes con Hansen como una herramienta menos invasiva, obteniéndose una buena correlación con la histopatología (78%-90%) (Ray et al., 2014). En el Instituto de Biomedicina, en conjunto con los estudiantes de Citotecnología de la Universidad Central de Venezuela, se han realizado esfuerzos para utilizar nuevos métodos de tinción para la bacteria.
El estudio serológico de los pacientes con lepra y la PCR son sin lugar a dudas, uno de los puntos más investigados actualmente. Desde la utilización de ensayos inmuno-enzimaticos (ELISA) para determinar anticuerpos contra el GLP-1 en casos y contactos, han surgido nuevas pruebas diagnósticas serológicas que buscan un diagnóstico precoz y estudio de contactos. Se han utilizado proteínas de la bacteria tales como ML0308, ML2498, ML0405 y ML2331, proteínas de fusión (LID-1), conjugados combinando GLP-1 sintético (ND) con proteína de fusión, ND-o-LID, mejorando la sensibilidad diagnóstica en pacientes con lepra y con eficacia corroborada en múltiples países suramericanos, y en zonas hiperendémicas. El Instituto de Biomedicina ha sido pionero en la implementación de dichas pruebas en Venezuela gracias al trabajo conjunto de la Dra Rada y el Dr Duthie, investigador reconocido a nivel mundial en la elaboración de nuevas pruebas serológicas en Hansen, logrando diversas publicaciones que avalan su utilidad (Duthie et al., 2007; Geluk et al., 2011; Rada et al., 2012; Duthie et al., 2014; Rada et al., 2017; Rada et al., 2019).
Además se ha diseñado una prueba rápida ND-o-LID-1 cuantificada por lector de Smart Phone que inmoviliza 2 antígenos en membrana de nitrocelulosa y detecta Inmunoglobulina (Ig) M e IgG de manera cualitativa y cuantitativa en 20 min después de adicionar el suero, con una Sensibilidad de 87% en MB y 21,2% en PB, con una especificidad 96.1%, valor predictivo positivo 94% y negativo 97% (Vaz Cardoso et al., 2013).
La PCR ha sido utilizada para el diagnóstico de casos mejorando la sensibilidad diagnóstica en PB al 80% e inclusive detectando micobacterias en un 44% de pacientes con lesiones únicas. La técnica de tiempo real permite medir efectividad del tratamiento cuantificando carga bacteriana y por transcriptasa reversa se puede abordar la viabilidad bacteriana (al detectar ARN), persistencia bacteriana y recaídas.
Como norma el tratamiento anti-hanseniano debe ser con más de una droga para evitar resistencia bacteriana. Existen 2 tipos de tratamiento: el estandarizado recomendado por la OMS y la terapia alternativa.
La OMS garantiza el acceso gratuito a los medicamentos a todo paciente que se encuentre bajo PQT estandarizada, que actualmente consiste en el esquema multibacilar (PQTMB), con una forma de presentación para adultos y otra para niños de 10 a 14 años. En los menores de 10 años o de bajo peso, la dosis debe ser ajustada al peso corporal. Los medicamentos vienen organizados en blíster y cada uno dura 28 días y debe ser supervisada la primera toma de medicamento de cada blíster. El tratamiento consta de 3 drogas: rifampicina, clofazimina y DDS y se administra por 6 meses en PB y por 12 meses en MB. Esto representa un cambio con respecto al tratamiento estándar anterior para la lepra PB, que era la rifampicina y DDS (PQTPB) durante 6 meses, debido a algunas pruebas que indicaron mejores resultados clínicos con un régimen de 3 medicamentos (PQTMB), simplificando el tratamiento, con mejor adhesión del paciente (WHO, 2018).
En estudio realizado en el Instituto de Biomedicina (Soucre et al., 2018), se evidenciaron efectos adversos a la PQT en el 29% de los pacientes, predominando en las mujeres y en formas multibacilares. Los principales efectos adversos encontrados fueron anemia (11%) y cefalea, atribuibles al DDS que mejoraron tras su eliminación.
Existen varias terapias alternativas que se utilizan en pacientes que rechacen algún medicamento, desarrollen efectos adversos graves o resistencia bacteriana. Adultos que rechacen clofazimina, se le administra rifampicina 600 miligramos (mg), una vez al mes, supervisada., DDS 100 mg. al día, autoadministrada. Etionamida o protionamida 250-375 mg al día, autoadministrada. También se puede sustituir la rifampicina en la PQT por claritromicina 500 mg al día en pacientes que no toleren rifampicina, teniendo en cuenta el potencial gastrolesivo de la claritromicina. Otros medicamentos empleados, son las quinolonas, minociclina, pero su efectividad no se equipara a la PQT y deben ser reservadas a casos particulares. Existe el esquema ROM (rifampicina 600 mg, ofloxacina 400 mg y minociclina 100 mg dosis única) que se puede utilizar en pacientes con lesión única PB. La terapia alternativa no está recomendada en las embarazadas ni en niños. Todos los medicamentos de la PQT estandarizada pueden utilizarse en el embarazo, monitorizando los posibles efectos adversos tales como la anemia en el caso del DDS. En pacientes con tuberculosis (TB) se dosifica la rifampicina acorde al esquema de TB y se mantienen el resto de los medicamentos. En el caso de pacientes inmunosuprimidos, se mantiene la misma terapia teniendo en cuenta las interacciones con los antiretrovirales en pacientes con el virus de Inmunodeficiencia adquirida (VIH) y evitando el DDS en pacientes que usen profilaxis con sulfas. Para la lepra resistente a la rifampicina, las pautas recomiendan el tratamiento con al menos dos medicamentos de segunda línea (claritromicina, minociclina o quinolona) más clofazimina por día durante 6 meses, seguidos de más uno de estos medicamentos por 18 meses adicionales. Cuando la resistencia a la ofloxacina también está presente, no debe usarse una fluoroquinolona como parte del tratamiento de segunda línea. El régimen de elección en tales casos consistirá en 6 meses de claritromicina, minociclina y clofazimina seguidos de claritromicina o minociclina más clofazimina durante 18 meses adicionales.
Las pautas de la OMS recomiendan el uso de una dosis única de rifampicina como tratamiento preventivo para los contactos de pacientes con lepra (adultos y niños a partir de 2 años), después de excluir la enfermedad de lepra y TB y en ausencia de otras contraindicaciones. En Venezuela no se dispone actualmente de rifampicina para dicho fin. Las dosis recomendadas son dosis única de 600 mg en pacientes mayores de 15 años, 450 mg de 10 a 14 años, 300 mg de 6 a 9 años, con peso mayor de 20 kilogramos (kg) y con menos de 20 kg, se le suministra 10-15 mg por kg de peso (WHO, 2018).
Con respecto a la prevención con vacunas, no existen recomendaciones estandarizadas al respecto. A pesar de ello la literatura concuerda que:
FR Tipo I: El tratamiento de elección es la prednisona o prednisolona a dosis de 0,3 a 1 mg por kg de peso día. Se puede utilizar como alternativa dexametasona 5-3mg por día, clofazimina por su efecto antiinflamatorio 300 mg diarios disminuyendo o espaciando la dosis de acuerdo a la evolución del paciente.
FR Tipo II: No está indicado suspender la terapia antilepromatosa, la droga de elección es la talidomida. Se le atribuyen los siguientes efectos: Antagonizan mediadores químicos de la inflamación, inhibe a los linfocitos T CD4+, disminuye niveles de TNF-alfa y la proliferación de inmunoblastos, inhibe la quimiotaxis de los polimorfonucleares y la actividad y fagocitosis del monocito macrófago, estabiliza la membrana lisosomal. La dosis habitual es de 100 a 400 mg por día o 6 mg por kg de peso por día, pero la dosis debe ser gradualmente descendida, de acuerdo a la evolución del paciente. Efectos adversos: teratogénesis, neuropatía periférica, edema distal de manos unilateral, constipación o diarrea, cansancio obnubilación, erupción cutánea, sequedad de boca. Está contraindicada absolutamente en mujeres embarazadas y en edad fértil a menos que estén esterilizadas y hay que vigilar su efecto protrombógeno Se ha descrito además el uso de esteroides sistémicos, methotrexate, azatioprina, pentoxifilina, terapia biológica anti TNc-α acorde a la disponibilidad de los medicamentos y evolución del paciente.
El control de la lepra se basa en un adecuado tratamiento multidroga lo cual limita la aparición de patógenos resistentes. (WHO, 2018). A pesar de ello se recomienda un monitoreo periódico del genotipo de la micobacteria para detectar la aparición de resistencia. En contraste con la TB, la prevalencia de resistencia primaria y secundaria en lepra es poco conocida. Dado la complejidad del método clásico de determinación de resistencia por inoculación en pata de ratón, el progreso de la biología molecular, el conocimiento del genoma y mecanismos moleculares de resistencia bacteriana ofrecen una oportunidad valiosa para determinar susceptibilidad a las drogas a través de la técnica de PCR (Williams et al., 2012; Martínez et al., 2014; Chauffour et al., 2018).
Se han realizado estudios por PCR en países con alta prevalencia de la enfermedad para determinar resistencia a los medicamentos utilizados en la quimioterapia. La resistencia al DDS, rifampicina, y ofloxacina involucra la sustitución de aminoácidos determinados por mutaciones en las regiones determinantes de resistencia a estas drogas. Se han estudiado mutaciones en los genes que codifican a la subunidad beta de la ARN polimerasa bacteriana (rpoβ) , en la resistencia a rifampicina, mutaciones en el gen folP1 para resistencia a DDS , y en el gen de la subunidad A de la ADN girasa (gyrA) para la ofloxacina. Por definición la determinación de resistencia es posible a través de un abordaje temprano a través del estudio en la secuenciación del ADN bacteriano. Se ha reportado resistencia al DDS en un 8-10%, a la rifampicina en un 1% y a la ofloxacina en un 1%. El porcentaje de resistencia antibacteriana se incrementa con los años de seguimiento de la enfermedad tras el alta y en recaídas (7.0 % vs 25.7 %). El subtipo 3 SNP de lepra es asociado más frecuentemente a recaídas, y es el que predomina en Suramérica. Más del 70% de las mutaciones en resistencia se asocian a recaídas (Guerrero et al., 2014; Beltrán-Alzate, 2016).
En Venezuela, hasta el año 2016 tras la evaluación de 197 casos de Hansen, sólo se ha encontrado 1 caso de resistencia bacteriana asociada al DDS (Singh et al., 2011). Los casos de recaída de la enfermedad para el año 2017 en Venezuela alcanzaban el 8%, y se han identificado pacientes del subtipo 3, por lo que se recomienda organizar la vigilancia rutinaria de la resistencia antimicrobiana empleando métodos moleculares simples, posibles a ser realizados con el apoyo de la OMS, para poder detectar a tiempo este fenómeno.
En un estudio realizado en el Instituto de Biomedicina Dr. Jacinto Convit, en pacientes con Enfermedad de Hansen MB, durante el período 2010-2013 a través de la evaluación histopatológica de biopsias de piel coloreadas con FF, se pudo evidenciar la presencia de formas sólidas asociadas a viabilidad bacteriana en un 48% de los pacientes tras un año de tratamiento recomendado por la OMS (Suarez et al., 2014). Es por ello que toma valor el estudio de PCR, no solo para evaluar resistencia bacteriana sino para poder realizar el correcto seguimiento de manera más objetiva, de la viabilidad bacteriana después del tratamiento, y de la curación del paciente o aparición de recidivas. A raíz de estos hallazgos consideramos que la terapia debe ser individualizada y se debe realizar un correcto seguimiento de los pacientes, con optimización de los criterios de alta, en donde un año en ocasiones, no es suficiente para la erradicación del bacilo.
La lepra es una enfermedad milenaria con grandes avances en la comprensión de la enfermedad, en especial en lo que se refiere al conocimiento del agente causal y elaboración de nuevas técnicas diagnósticas y de seguimiento del paciente. El Instituto de Biomedicina ha sido por excelencia un centro de formación, diagnóstico y manejo de la enfermedad de Hansen. Para obtener una visión de futuro, debemos volver al pasado con una institución fuerte para lo cual es fundamental el trabajo conjunto del Ministerio-Hospital Vargas, la UCV, OPS y OMS, con enlaces internacionales con otros grupos y centros de investigación en donde todos con nuestro trabajo, somos necesarios e importantes para conseguir las metas propuestas por la OMS para la eliminación de la enfermedad. Las líneas de trabajo que maneja la institución se enfocan actualmente en tratar de optimizar el registro, reporte y seguimiento de casos, llevar el tratamiento estándar y anti-reaccional a los pacientes, y mantener la investigación en los aspectos epidemiológicos, microbiológicos, serológicos y genéticos de la bacteria, sin descuidar la docencia y formación necesaria para crear una generación de relevo para el control de la lepra.