Se actualizan los datos más relevantes en cuanto a diversidad genómica de las especies de hongos responsables de las micosis profundas sistémicas, Paracoccidioides spp, Histoplasma spp, y Coccidioides spp. Estos hongos comparten una característica principal, su dimorfismo. La histoplasmosis posee una distribución mundial, predominando en América y África. La paracoccidioidomicosis es exclusiva de América Latina. La coccidioidomicosis se encuentra principalmente en las regiones desérticas de Estados Unidos, México y América Central y del Sur. Recientemente, se han realizado estudios de secuenciación del genoma y análisis filogenéticos, con estos hongos patógenos utilizando cepas venezolanas y de otras regiones. A partir del 2017 se ha propuesto el siguiente reordenamiento taxonómico para Histoplasma: Histoplasma ohiense sp. nov. grupo NAm 2, Histoplasma mississippiense sp. nov. forma el grupo Nam1, Histoplasma suramericanum sp. nov. forma el grupo LAm A, H. capsulatum sensu stricto, H. capsulatum var. duboisii en África. En cuanto al género Paracoccidioides, se proponen cinco especies, Paracoccidioides lutzii (similar a Pb01), P. brasiliensis (S1) P. americana (PS2), P. restrepiensis (PS3) y P. venezuelensis (PS4). Con relación a la coccidioidomicosis se confirmó que la especie de C. posadasii es endémica en Sur América y que los aislados clínicos y ambientales de Venezuela pertenecen a la especie posadasii. Finalmente, podemos concluir que los aislados venezolanos se llamarán ahora: H. suramericanum, P. venezuelensis y C. posadasii.
Palabras clave: Micosis endémica; Histoplasmosis; Paracoccidioidomicosis; Coccidioidomicosis; Genómica.
This work updates the most relevant data regarding the genomic diversity of the fungal species responsible of systemic deep mycosis, Paracoccidioides spp, Histoplasma spp, and Coccidioides spp. These specific fungi share a main characteristic which is their thermodymorphism. Histoplasmosis has a worldwide distribution, prevailing in America and Africa. Paracoccidioidomycosis is exclusive of Latin America. Coccidioidomycosis is found mainly in the desert regions of the United States, Mexico, and Central and South America. Genome sequencing studies and phylogenetic analyzes have been carried out with these pathogenic fungi using strains from Venezuela and other regions. As of 2017, the following taxonomic rearrangement has been proposed for Histoplasma: H. ohiense sp nov. NAm 2 group, H. mississippiense. sp. nov. forms the Nam1 group, H. suramericanum sp. nov. forms the LAm A group, H. capsulatum sensu stricto. H. capsulatum var. duboisii in Africa. Regarding the genus Paracoccidioides, five species are proposed, Paracoccidioides lutzii (similar to Pb01), P. brasiliensis (S1) P. americana (PS2), P. restrepiensis (PS3) and P. venezuelensis (PS4). Regarding coccidioidomycosis, it is confirmed that the C. posadasii species is endemic in South America and that the clinical and environmental experts from Venezuela affected the posadasii species. Finally, we can conclude that the Venezuelan isolated are now called: H. suramericanum, P. venezuelensis and C. posadasii.
Key words: Endemic micosis; Histoplasmosis; Paracoccidioidomycosis; Coccidioidomycosis; Genomic.
Las enfermedades provocadas por hongos patógenos afectan a más de 300 millones de personas, que padecen enfermedades graves relacionadas con las micosis. Así mismo, se ha reportado que fallecen más de 1.6 millones de personas anualmente, más que la malaria y en la misma magnitud que la tuberculosis (Bongomin et al., 2017). Por otro lado, son responsables de la pérdida anual de un tercio de la producción agrícola mundial (Fisher et al., 2012). En estos momentos, el número de especies del reino de los hongos se puede estimar entre 2.2 a 3.8 millones, considerando que hay 120.000 especies actualmente aceptadas e identificadas hasta ahora (Hawksworth, 2001; Hawksworth et al., 2016). De los 4 millones de especies, solo unos 300 son patógenos al hombre, dentro de ellos los que producen las Micosis Profundas Sistémicas (MPS), pertenecientes al orden Onygenales, familia Onygenaceae.
La diversidad geográfica y climática de América Latina proporciona una gran diversidad de ecosistemas, que permiten el desarrollo de diferentes microorganismos, incluidos los hongos patógenos. Las micosis endémicas como histoplasmosis, paracoccidioidomicosis y coccidioidomicosis, son enfermedades frecuentes en países en vías de desarrollo y en países desarrollados con áreas en las que las circunstancias ambientales facilitan el desarrollo de los hongos que las producen (Queiroz-Telles et al., 2017).
El fenómeno biológico común que presentan los hongos causantes de MPS es su dimorfismo, es decir, crecen en forma saprofita en los suelos donde se encuentran en forma micelial y sus conidios son aerotransportados, logrando entrar por inhalación en los pulmones del humano, aquí el cambio de temperatura promueve su transformación a su forma levaduriforme patógena (Ashraf et al., 2020).
Las MPS causadas por hongos dimorfos tienen como puerta de entrada la respiratoria. Posteriormente, la gravedad y magnitud de la infección dependerá del tamaño del inóculo y del estado inmunitario del hospedador. La mayoría de los individuos con estas infecciones permanecen asintomáticos, o con síntomas respiratorios leves, lo que puede ocurrir en individuos inmunocompetentes, pero en pacientes inmunodeficientes, la diseminación puede ocurrir involucrando varios órganos, incluido orofaringe, ganglios linfáticos, hígado, bazo, piel y glándulas suprarrenales (Carrasco-Zuber et al., 2016).
La histoplasmosis posee una distribución mundial y aunque se ha encontrado en los cinco continentes, la enfermedad predomina en América y África (Wheat et al., 2016). La paracoccidioidomicosis es una micosis sistémica, exclusiva de América Latina y los casos autóctonos se registran desde México hasta Argentina (Cantero, 2018). La coccidioidomicosis, presenta dos especies C. posadasii y C. immitis; la principal diferencia entre estas dos especies es su distribución geográfica. C. immitis se encuentra principalmente en las regiones desérticas del centro y sur de California (incluida Baja California), mientras que C. posadasii se encuentra en las regiones desérticas de Nevada, Arizona, Nuevo México, el oeste de Texas, México y América Central y del Sur (Kirkland et al., 2018).
En Venezuela, la histoplasmosis, paracoccidioidomicosis y coccidioidomicosis, tienen carácter endémico. Las dos primeras se han reportado en casi todo el territorio nacional y la última se encuentra en las zonas semiáridas bien delimitadas en los estados Lara, Falcón y Zulia (Martínez et al., 2013).
Este artículo detalla brevemente los aspectos epidemiológicos de cada micosis y los cambios taxonómicos recientes.
Es una micosis profunda causada por un hongo dimorfo, el Histoplasma capsulatum. Fue descubierta por Darling, un anatomopatólogo norteamericano en Panamá en 1905 (Rippon, 1988). Esta enfermedad afecta el sistema reticuloendotelial humano y se adquiere por inhalación de microconídios y pequeños fragmentos del micelio, que tras la llegada al alvéolo pulmonar son capturados por los macrófagos por opsonofagocitosis o por unión a sus receptores de superficie celular (López, 2006). Geográficamente, Histoplasma tiene el rango más amplio de distribución de todos los hongos dimórficos, aunque alguna vez se pensó que estaba confinado geográficamente a regiones de las Américas, actualmente se han notificado casos de histoplasmosis en todo el mundo. Las causas de esta distribución expandida siguen siendo inciertas, el cambio climático ha generado el calentamiento global de los ecosistemas que favorece el crecimiento de hongo y por otro lado, la pandemia del SIDA ha proporcionado hospederos humanos más susceptibles (Wheat et al., 2016). La histoplasmosis se ha encontrado en los cinco continentes, menos en la Antártida, predominando en América, en particular en los Estados Unidos con áreas altamente endémicas, menor incidencia en Centroamérica, con la excepción de Panamá, y en Suramérica, en Venezuela, Brasil, Colombia y Argentina. En Asia, África, cuenca del Mediterráneo y Europa los reportes son esporádicos (Colombo et al., 2011).
El Histoplasma spp crece de 22°C a 29°C, con precipitación aproximada de 1.200 mm, humedad relativa entre 67 a 87% y con una preferencia de suelos calizos. Además, está presente en suelos con alto contenido de nitrógeno, asociado a excrementos de pájaros y murciélagos (Bastardo de Albornoz, 1996).
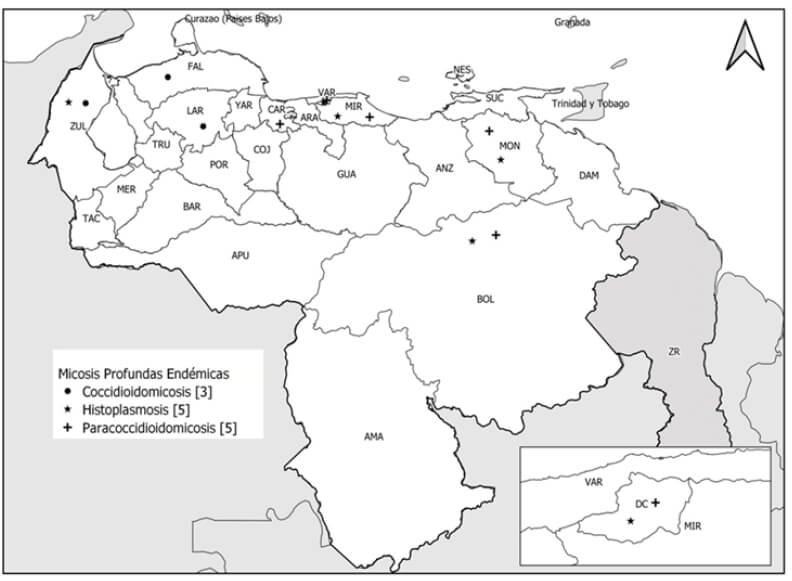
En Venezuela, esta enfermedad fue identificada en 1949 y posteriormente confirmada en 1953, (Campins et al., 1953). Los estados donde se ha reportado la mayoría de los casos son Zulia, Monagas, Miranda, Distrito Capital y Bolívar (Figura 1). La histoplasmosis es una de las micosis sistémicas más frecuente en pacientes con SIDA. En el estudio de 1984 a 2010, se reportaron 663 casos (Martínez et al., 2013).
Posteriormente, en el trabajo del 2000 al 2005 se diagnosticaron 158 casos (Mata-Essayag et al., 2008). Los diferentes estudios muestran cambios en la epidemiología que ocurre en Venezuela, tal vez debido a cambios ambientales y a la aparición y desarrollo de la pandemia del SIDA, los casos de histoplasmosis están subestimados en el país (Mata-Essayag et al., 2018).
Los recientes estudios de secuenciación del genoma completo de poblaciones y los análisis filogenéticos del género Histoplasma promueven la existencia de cuatro especies cripticas, H ohiense sp. nov. (grupo NAm 2), H mississippiense sp. nov. (grupo Nam1) circulando en Norte América, H. suramericanum sp. nov. (grupo LAm A) circulando en Suramérica y en particular en Venezuela y H capsulatum sensu stricto distribuido en Panamá con una variedad Histoplasma capsulatum var. duboisii que se encuentra en África. (Sepúlveda et al., 2017).
Es una micosis sistémica granulomatosa causada por el complejo Paracoccidioides brasiliensis, exclusivo de América Latina y los casos autóctonos se registran desde México hasta Argentina. La historia de la paracoccidioidomicosis está ligada a Brasil, por ser este país la zona más endémica de esta micosis. El primer caso reportado fue en 1908 por Adolfo Lutz, quien estudió a un paciente con lesiones nasofaríngeas y adenopatías cervicales; observó al microscopio el hongo en su estado parasitario como un microorganismo multigemante, obtuvo los cultivos y comprobó el dimorfismo; no dio nombre al agente etiológico y reportó a la enfermedad como “hifoblastomicosis seudococcidioidal”. La vía de infección del P. brasiliensis es la respiratoria, dando un cuadro asintomático o subclínico; más tarde se puede diseminar a piel y otros órganos (Méndez et al., 2017).
En general, todas las zonas endémicas de la enfermedad son subtropicales y tropicales, ubicadas entre los 500 y 1.500 m sobre el nivel del mar, con una precipitación constante que fluctúa entre los 900 y 2.000 mm por año y con temperatura entre los 17°y 24°C; son regiones de abundantes bosques con árboles nativos y atravesadas por ríos, con inviernos cortos y veranos lluviosos, la paracoccidioidomicosis está asociada a la población rural (Cantero, 2018), representa una infección significativa en América del Sur, presente principalmente en Brasil (80%), Venezuela, Argentina y Colombia (Souza et al., 2019).
En Venezuela los primeros casos de PCM fueron descritos por (O´Daly, 1937) y luego por Guerra quien destaca la importancia de la localización pulmonar de este hongo (Guerra, 1948). Posteriormente en 1971, se realizó el primer aislamiento del hongo en suelo venezolano (Albornoz, 1971).
En cuanto a los primeros estudios epidemiológicos en Venezuela sobre la frecuencia de PCM, fueron realizados desde 1985 por los Grupos de Trabajo de Micología de Venezuela, reportando que la PCM es la micosis endémica más importante en el país, encontrándose casos en casi todos los estados, aunque la mayoría de los reportes pertenecen a los estados Bolívar, Miranda, Carabobo, Monagas y Distrito Capital (Martínez et al., 2013; Cermeño et al., 2004) (Figura 1). En el 2013 se reportaron 674 casos, diagnosticados entre 1984 a 2010 (Martínez et al., 2013). Posteriormente, en el trabajo de 1997 al 2001 del Instituto Nacional de Higiene “Rafael Rangel” se reportaron 65 casos de PCM y se resalta que, con la pandemia de SIDA, esta micosis sigue tomando gran importancia a nivel nacional (Reviakina et al., 2002).
Con base a recientes estudios de análisis de genética poblacional, se considera que el agente etiológico pertenece a un complejo que incluye 5 especies crípticas: S1, PS2, PS3, PS4, and P. lutzii, en Venezuela circulan dos de ellas, P. americana (PS2) y P. venezuelensis (PS4) (Texeira et al., 2014).
Es una micosis profunda causada por dos especies del hongo dimórfo Coccidioides, las especies immitis y posadasii; se caracteriza por una gran variedad de manifestaciones clínicas, desde coccidioidomicosis primaria pulmonar a coccidioidomicosis progresiva o diseminada, que afecta piel, tejido celular subcutáneo, ganglios linfáticos, huesos, articulaciones, vísceras y sistema nervioso central (Bonifaz, 2015; Jenks et al., 2020).
Coccidioides immitis está restringido a la zona californiana de Estados Unidos y Coccidioides posadasii está presente en otras regiones de Estados Unidos y en el resto del Continente. Son hongos de estructuras muy similares pero diferentes genéticamente. Coccidioides es uno de los hongos más virulentos por lo que es un agente para el desarrollo de bioterrorismo (Jenks et al., 2020).
El primer caso de coccidioidomicosis fue reportado en 1892 en Argentina por Posadas, dos años más tarde, Gilchrist y Rixford comunicaron un nuevo caso en California, USA, proveniente del Valle de San Joaquín. Inicialmente, se clasificó al agente etiológico como un protozoario de la clase Sporozoa y se denominó, por su similitud con las coccidias, Coccidioides immitis (Deresinsk et al., 2019). Posteriormente, en 1900 Ophüls estudió un tercer caso y de nuevo obtuvo los cultivos y junto con Moffit, propusieron que el agente etiológico era un hongo “dimorfo”, logrando desarrollar la enfermedad en animales, cumpliendo así los postulados de Koch. En 1905, el mismo Ophüls publicó su trabajo y describió el ciclo de vida del hongo, que es el que se conoce prácticamente hasta la actualidad (Ophüls, 1905).
Se ha comprobado que Coccidioides sp, puede crecer en medios pobres con variabilidad de pH, sin embargo, su mayor desarrollo se alcanza en medios ricos estériles o con poca competencia (otras especies fúngicas), quizás por el poco poder bioquímico que tiene este hongo para degradar nutrientes, lo cual explica por qué se limita a suelos pobres y con condiciones extremas. El hongo puede vivir de 5 a 30 cm debajo de la tierra y donde existe una fauna pobre, constituida predominantemente por plantas xerófitas (cactáceas), arbustos y matorrales como Larrea tridentata (“gobernadora”), y roedores como ratones, zarigüeyas y ardillas de tierra, que tienen el papel de vectores indirectos de la enfermedad (Bonifaz, 2015).
Estas condiciones se presentan en las zonas endémicas del Continente Americano que quedan incluidas dentro de la clasificación ecológica de zonas semidesérticas; están formadas por tierras arcillosas y arenosas, con escasa capacidad para retener el agua de las pocas precipitaciones pluviales, que fluctúan entre 150-500 mm por año, con temperatura promedio de 28°C en verano y 7°C en invierno.
En general, Latinoamérica tiene una alta proporción de población rural dedicada al trabajo agrícola, expuestos a la inhalación o inoculación transcutánea de artroconidias de Coccidioides. (Laniado-Laborín et al., 2019; Bonifaz, 2015).
Se han reportado casos de coccidioidomicosis en Venezuela desde 1948, principalmente en las regiones semidesérticas del noroeste del país entre 9° y 12° de latitud norte (Campins, 1970). La zona endémica árida y semiárida está restringida a los estados Zulia, Lara y Falcón (Figura 1), que se caracterizan por climas cálidos, áridos y secos, baja altitud, vegetación xerofítica, suelos arenosos con altas concentraciones de sal (boro y sulfato de calcio) y pH alcalino, que presumiblemente es favorable para el desarrollo de Coccidioides (Martínez et al., 2015; Martínez et al., 2010). Su mayor frecuencia de reproducción se lleva a cabo en los meses cálidos y de mayor precipitación pluvial; no obstante, es en la época de sequía cuando la enfermedad se puede adquirir con más facilidad, debido a que se originan fuertes polvaredas que remueven el hongo y transportan las esporas.
En 2002, se diferenciaron dos especies mediante técnicas de biología molecular (secuencias de nucleótidos), dejando a C. immitis para la zona de California, EU, y C. posadasii, para otros estados de Norteamérica y la mayoría de los aislamientos del resto del continente (Fisher et al., 2002).
La identificación de especies crípticas y la delimitación de las especies en hongos, ha impulsado la investigación para identificar diferencias en morfología, estrategias de virulencia, susceptibilidad a medicamentos y su historia natural. Dilucidar los límites de especies sería beneficioso no solo para comprender la sistemática y evolución de los hongos patógenos, sino también para observar si las diferencias en las manifestaciones clínicas de las micosis, en diferentes regiones regiones geográficas, se atribuyen a la existencia de diferentes especies crípticas dentro del género (Taylor et al., 2006; Taylor et al., 2000).
Por otro lado, la evolución biológica, ha originado la diversidad que presentan los hongos a partir de un ancestro común. Por lo que los estudios filogenéticos, son esenciales porque permiten identificar mutaciones y distintos linajes que logran evidenciar las variaciones de las cepas por regiones. Es por ello, que identificar la cepa específica, ubicación geográfica y su mutación ayudaría a comprender su desarrollo y ampliar las herramientas de diagnóstico en cuanto a la diversidad genética demográfica (Taylor et al., 2000).
Con el fin de establecer la biodiversidad genómica de los hongos productores de micosis profundas en estos géneros, se han realizado diferentes trabajos. En el 2017, se efectuó la secuenciación del genoma y análisis filogenéticos del genero Histoplasma (Sepúlveda et al., 2017). En ese trabajo utilizaron 21 aislados de USA, 7 de América Latina y 2 de África. La exploración sistemática de diferencias fenotípicas reveló que el género Histoplasma engloba una gran diferenciación en términos de virulencia, morfología y estrategias patogénicas. Además, demostraron que las diferencias fenotípicas coinciden con la diferenciación genética y filogenética y son probablemente el resultado de eventos previos de especiación no identificados dentro de Histoplasma (Sepúlveda et al., 2017).
En base a sus resultados y con un alto nivel de concordancia genómica propusieron un reordenamiento taxonómico del género de Histoplasma de la siguiente manera:
Por otra parte, el hongo patógeno Paracoccidioides spp inicialmente constituido por cinco especies filogenéticas, de las cuales cuatro formaban el complejo de especie brasiliensis. La genealogía de genes nucleares apoyaba este escenario divergente, pero los loci mitocondriales no; es decir, que mientras todas las especies pertenecientes al complejo brasiliensis están diferenciadas en la codificación del loci nuclear, esto no ocurría con el loci mitocondrial. En el 2017, se abordó la búsqueda de la fuente de esta incongruencia, utilizaron 11 fragmentos de genes previamente publicados, 10 nuevas secuencias de regiones no codificantes nucleares y 10 micro satélites (Turissini et al., 2017). Finalmente, pudieron demostrar que esta incongruencia mitocondria/núcleo en el complejo de especies brasiliensis surgió de una hibridación interespecífica y la introgresión mitocondrial, fenómenos comunes en eucariotas. Por último, Turissini et al., 2017 propusieron elevar 4 de estas especies filogenéticas de Paracoccidioides al criterio formal de especies de esta manera: Paracoccidioides lutzii (similar a Pb01), P. brasiliensis (S1) P. americana (PS2), P. restrepiensis (PS3) y P. venezuelensis (PS4).
Por otra parte, en el 2016 se identificó una división del linaje S1 en dos clados que denominaron S1a y S1b (Muñoz et al., 2016). Además, encontraron evidencias de un mayor intercambio genético entre el linaje S1b y todos los demás linajes, lo que puede explicar el amplio rango de dispersión geográfica que muestra S1b (Muñoz et al., 2016). También, hallaron evidencia de selección positiva para los genes del antígeno GP43 y PGA1 y genes que codifican otras proteínas, proteasas secretadas y mutaciones en los genes de proteasas y de pared celular; en conjunto todos estos eventos pueden contribuir a la virulencia y a la variación de la respuesta inmune del hospedero entre los aislamientos naturales de Paracoccidioides spp.
En particular, las especies de Paracoccidioides muestran superposición de área geográfica. Por lo que se piensa que Brasil y Venezuela albergan más de una especie de Paracoccidioides, abriendo la posibilidad de intercambio de genes entre las especies P. americana y P. venezuelensis coexistentes en Venezuela (Teixeira et al., 2014); y P. americana, P. brasilienses sensu stricto y P. lutzii coexistentes en Brasil (Muñoz et al., 2016; Teixeira et al., 2014).
Teixeira et al. (2020), publicó un trabajo donde se incluyó 31 aislamientos de Paracoccidioides provenientes de Argentina, Bolivia, Brasil, Paraguay, Perú y Venezuela, los cuales fueron secuenciados nuevamente. Los genomas de estos aislamientos se compararon con los genomas disponibles públicamente; en primer lugar se reafirmó que los aislados venezolanos son P. venezuelensis y pueden coexistir junto con P. americana.
Por otro lado, P. restrepiensis coexiste con P. brasiliensis sensu stricto en las mismas localidades y otras especies de Paracoccidioides también muestran superposición de rango geográfico: P. brasiliensis coexiste con P. lutzii y P. americana.
Con relación a la PCM en Argentina y Paraguay, estudios previos de cuatro cepas provenientes de estos países, habían sido genotipadas usando diez loci nucleares secuenciados. Estos cuatro aislamientos habían sido denominados P. brasiliensis sensu stricto (Matute et al., 2006; Turissini et al., 2017). Posteriormente, en el estudio del 2020, se demuestra que PCM en Argentina y Paraguay es causada por tres genotipos de Paracoccidioides, P. brasiliensis (S1a y S1b) y P. restrepiensis (PS3) (Texeira et al., 2020). Además, se encontró que los aislados de P. brasiliensis S1a de Argentina se asocian frecuentemente con formas crónicas de la enfermedad. Estos resultados proponen, que los aislamientos secuenciados para comprender la diversidad genética de Paracoccidioides en Suramérica, sugieren que en estas regiones residen múltiples especies de Paracoccidioides, revelando la importancia del muestreo sistemático en la definición del área geográfica de cada uno de estos patógenos (Teixeira et al., 2020).
Con relación a la coccidioidomicosis, se caracterizaron muestras de Coccidioides spp, de suelos venezolanos y se plantearon la detección molecular de Coccidioides spp. en áreas endémicas de Venezuela y compararon las secuencias obtenidas con los perfiles genéticos de Coccidioides de secuencias clínicas disponibles en el GenBank (Alvarado et al., 2018). Las muestras de suelo fueron recolectadas de los municipios Urumaco, Sucre y Democracia en el estado Falcón y en los municipios Urdaneta y Torres localizados en el estado Lara. De cada sitio se estudió: tipo de suelo, composición físico-química, tipo de suelo, composición físico-química, tipo de vegetación, coordenada geográfica, medición de temperatura y precipitación. Posteriormente, se efectuó la extracción de ADN de los suelos y se realizó la detección molecular de Coccidioides spp por PCR en tiempo real, amplificación de ITS2, secuenciación y análisis filogenético (Alvarado et al., 2018).
En este trabajo se encontró, que la especie de C. posadasii es endémica en los municipios de zonas áridas y semiáridas de Venezuela, ya que pudieron detectar ADN específico de Coccidioides posadasii en todas las áreas muestreadas. Se encontró alta concentración de ADN de Coccidioides en los municipios, Urumaco, Sucre, Democracia (estado Falcón), moderada concentración de ADN en los municipios, Urdaneta y Torres (estado Lara) y baja concentración de ADN en los municipios Urdaneta y Torres.
Teixeira et al. (2019), estudiaron aislados clínicos venezolanos, secuenciaron 10 aislamientos de Coccidioides spp, y establecieron su relación con 72 aislamientos secuenciados previamente por otros autores. En primer lugar se encontró, que todos los aislados pertenecen a la especie C. posadasii; además, siete de los aislados venezolanos forman un grupo monofilético con poca diversidad, que se diferencia de otras poblaciones de C. posadasii. Así mismo, se encontró que las poblaciones centroamericanas de C. posadasii son el resultado de una mezcla entre América del Norte y Venezuela. Estos hallazgos revelan la importancia de caracterizar las poblaciones tropicales de Coccidioides y cómo residen distintas variantes genéticas en ellas, así como las probables diferencias fenotípicas entre las poblaciones que permiten contribuir al conocimiento de la evolución de otras poblaciones en regiones subtropicales y templadas.
Finalmente, podemos concluir de los estudios genómicos que se han realizado, que los aislados de hongos productores de micosis sistémicas en Venezuela se denominan: Histoplasma suramericanum, Paracoccidioides venezuelensis y Coccidioides posadasii.