El Instituto de Biomedicina “Dr. Jacinto Convit”, como resultado de años de experiencia e investigación, ha desarrollado productos biológicos para el diagnóstico de diferentes enfermedades tales como: la leishmaniasis, las micosis sistémicas, las infecciones entéricas producidas por bacterias y la infección por Helicobacter pylori. A lo largo de los años se ha conformado un equipo multidisciplinario de investigadores que conforman los diferentes laboratorios de: Bioquímica, Micología, Enfermedades Entéricas y Microbiología Molecular. Estos productos se desarrollaron inicialmente como parte del avance de las diferentes líneas de investigación en cada uno de los laboratorios y actualmente, cumplen con el objetivo de dar respuesta a la demanda de diagnóstico de estas enfermedades endémicas de gran importancia en Venezuela. Contribuyendo de esta manera con la investigación, la academia, la formación de nuevos talentos y planteando la innovación como un proceso productivo y sostenible de nuestro país.
Palabras clave: Leishmanina; micosis sistémicas; diarreas; Helicobacter pylori; diagnóstico.
The Institute of Biomedicine “Dr. Jacinto Convit”, throughout his scientific experience, has developed biological products for the diagnosis of different diseases such as: leishmaniosis, systemic mycoses, enteric infections caused by bacteria and Helicobacter pylori infection. Over the years, a multidisciplinary team of researchers has been formed that make up the different laboratories of: Biochemistry, Mycology, Enteric Diseases and Molecular Microbiology. These products were initially developed as part of the advancement of the different lines of research in each of the laboratories and currently with the objective of responding to the demand for diagnosis of these endemic diseases of great importance in Venezuela. Contributing in this way with research, the academy, the training of new talents and proposing innovation as a productive and sustainable process in our country.
Key words: Leishmanina; systemic mycosis; diarrhea; Helicobacter pylori; diagnosis.
El Instituto de Biomedicina “Dr. Jacinto Convit” tiene una amplia trayectoria en el estudio de diversas enfermedades que afectan a la población venezolana. A lo largo de los años se ha conformado un equipo de investigación cuya trayectoria profesional fue influenciada por su fundador y director; el Dr. Jacinto Convit. En la búsqueda de aportar soluciones a los problemas de salud pública, este equipo ha desarrollado productos biológicos para el diagnóstico de algunas enfermedades endémicas de gran importancia en Venezuela como lo son: la leishmaniasis, las micosis, las diarreas entéricas y la infección por Helicobacter pylori. Estos productos han sido elaborados a partir de cepas autóctonas, por lo que son altamente específicos para los pacientes en Venezuela. Además, al ser producidos en el país se garantiza su accesibilidad y bajo costo. El enfoque del equipo está fundamentado en la máxima optimización de los espacios y las funciones, para lograr generar estos productos con altos estándares de calidad, orientados a satisfacer la gran necesidad de diagnóstico de distintas endemias en el país, con la visión a futuro de abastecer los servicios de salud a nivel nacional y así ofrecer estas pruebas de diagnóstico a toda la población.
La Leishmaniasis es una enfermedad causada por un protozoo parásito del género Leishmania, que es transmitido a través de la picadura de flebótomos infectados. La infección se presenta como un espectro clínico que puede ir desde lesiones ulcerativas en el lugar de la picadura, hasta la producción de un compromiso visceral diseminado que puede causar la muerte. Este rango de manifestaciones, ha permitido describir tres formas clínicas principales de leishmaniasis: la visceral (la forma más grave de la enfermedad, a menudo conocida como enfermedad de kala-azar), la cutánea (más frecuente) y la forma mucocutánea (Convit et al, 1993).
Esta enfermedad afecta a las poblaciones más pobres del planeta, está asociada a diversos factores ambientales, la malnutrición, los desplazamientos de poblaciones, las malas condiciones de vivienda, la falta de recursos económicos y la debilidad del sistema inmunitario (Convit, 1974; Convit, 2005).
El último reporte sobre el estado de la infección por leishmaniasis en Venezuela, correspondiente al año 2017, muestra un incremento significativo en el número de casos de leishmaniasis cutánea y mucosa en el país. El informe reporta que durante este año se registraron 2.326 casos nuevos, con una incidencia de 11,26 por 100.000 habitantes (OPS, 2019). Esta importante incidencia impulsa la necesidad de contar con pruebas que permitan un diagnóstico eficiente y oportuno de la infección.
El diagnóstico de la Leishmaniasis está basado en cuatro criterios fundamentales: clínico, epidemiológico, inmunológico y parasitológico. La Leishmanina o Prueba de Montenegro (IDR) es una de las pruebas de diagnóstico más utilizadas y consiste en la inoculación por vía intradérmica en el antebrazo de una suspensión de 0,1 mL de antígeno de promastigotes de Leishmania muertos por calor en una concentración de 6,25 x 106 promastigotes por mL, Esta prueba es de reconocida utilidad en estudios epidemiológicos y como apoyo en el diagnóstico diferencial de la leishmaniasis tegumentaria ya que permite evaluar la inmunidad mediada por células a través de la reacción de hipersensibilidad (Furuya et al, 1989). La lectura de la Leishmanina, se realiza a las 48 horas posteriores a la inoculación, utilizando la técnica del bolígrafo, y su interpretación en el país se efectúa según los criterios establecidos por el Programa Control de la Leishmaniasis en Venezuela (MPPS 2019), considerando positiva la reacción cuando el diámetro de la induración (consecuencia de la estimulación celular) es de 10 mm o más.
La Leishmanina es una alternativa en el diagnóstico presuntivo y diferencial de la leishmaniasis, siendo ampliamente utilizada por el bajo costo de su producción y por la facilidad de su aplicación e interpretación, sobre todo en el medio rural donde se encuentran los mayores porcentajes de personas afectadas. En este sentido, cabe destacar que el Instituto de Biomedicina “Dr. Jacinto Convit” a lo largo de la historia ha realizado grandes esfuerzos formando al personal de salud tanto a nivel local como a nivel de los diferentes Servicios de Dermatología Sanitaria del país.
Desde el año 1984 en el Laboratorio de Bioquímica del Instituto Biomedicina “Dr. Jacinto Convit”, se elabora la Leishmanina, siendo que su producción y utilización se ha mantenido en el tiempo, cumpliendo así con el legado de la labor del Dr. Jacinto Convit quien desde sus inicios dirigió su producción y dejó, de manera innegable, grandes contribuciones en el estudio de la leishmaniasis en Venezuela (Convit et al., 1987; Convit et al., 2004).
La Leishmanina elaborada en el Instituto de Biomedicina “Dr. Jacinto Convit” es un antígeno producido con la especie de Leishmania mexicana pifanoi (LEM 279), tipificada por el Centro Nacional de Referencia de Leishmaniasis, Laboratorio de Parasitología del Dr. Jean-Pierre Dedet en Montpellier Francia, bajo el código de identificación:
CNRL Code:LEM 279
WHO Code: MHOM/VE/57/LL1
TAXON: Leishmania Pifanoi
ZYMODEME: MON-40
Para su producción, los ejemplares del parásito Leishmania se crecen en medio de cultivo suplementado con nucleótidos, vitaminas, y antibióticos. Los promastigotes son recogidos en su fase logarítmica, son resuspendidos y envasados en viales certificados, para posteriormente ser inactivados por calor (Pan, 1984). En cada fase, son realizados los correspondientes controles de esterilidad para verificar la ausencia de bacterias, hongos y micobacterias, así como también los ensayos de inocuidad para probar toxicidad.
La Leishmanina contribuye sin duda, en una manera fácil, económica y eficiente al diagnóstico presuntivo de la enfermedad, que junto a otros métodos directos que evalúan la presencia del agente causal, coadyuvan a su diagnóstico definitivo. Por tanto, potenciar el desarrollo y producción de la Leishmanina aporta beneficios indiscutibles en la población afectada por esta enfermedad.
La diarrea aguda infantil continúa siendo la segunda causa de muerte en la población menor de 5 años; 499.000 niños fallecen por diarrea anualmente en el mundo, representando esta cifra el 8,6% de las muertes por todas las causas en este grupo de edad (GBD Diarrhoeal Diseases Collaborators, 2017). Venezuela, no escapa a esta problemática; para el año 2016 la diarrea aguda resultó ser la tercera causa de consulta, con 2.208.623 eventos en toda la población. De este total, 38,7% (853.698 casos) correspondieron a la población menor de 5 años, observándose además en este grupo de edad, un incremento de 187.310 casos con respecto al año 2015 (Boletín Epidemiológico MPPS, 2017).
Entre las bacterias que causan diarrea aguda infantil, Escherichia coli enteropatógena (ECEP) es una de las más importantes en el mundo, registrándose la mayor frecuencia de la infección en la población menor de 2 años, disminuyendo considerablemente el número de infecciones con la edad (Lanata et al., 2017). Se estima que EPEC es responsable del 5-10% de las diarreas pediátricas en países en desarrollo como Brasil, Chile, Perú e Irán (Lanata et al., 2017, Gómes et al., 2016). En Venezuela, los trabajos realizados muestran igualmente el impacto de la infección por ECEP en la población infantil, reportando en algunos casos, como en Caracas y el estado Sucre frecuencias superiores al 30% (González et al., 2018; Michelli et al., 2016).
Una de las metodologías utilizadas para la identificación de ECEP es la seroagrupación, mediante la utilización de sueros polivalentes que evidencian la presencia de los antígenos somáticos “O”. Sin embargo, la adquisición de estos sueros en el mercado es de alto costo, debido a que son productos importados.
De manera que la alta frecuencia de ECEP en la población infantil con diarrea aguda y el elevado costo de los estuches de diagnóstico, justifican la búsqueda de alternativas que permitan la adecuada y oportuna identificación del patógeno.
El Servicio Autónomo Instituto de Biomedicina “Dr. Jacinto Convit” (SAIB), a partir del año 2010, inició la producción de sueros polivalentes para la identificación de cepas ECEP aisladas de muestras de heces. La concepción del producto consiste en la obtención de sueros polivalentes, elaborados a partir de cepas de referencia y que mediante la técnica de aglutinación en lámina permitan la rápida identificación del patógeno.
El estuche de diagnóstico consiste de tres polivalentes que permiten la identificación de la ECEP, mediante la detección de los antígenos somáticos “O”. Cada estuche de diagnóstico está compuesto por tres polivalentes: polivalente I (factores O26, O55, O88), polivalente II (factores O119, O125, O126) y polivalente III (factores O114, O142, O158). Cada polivalente fue evaluado internamente mediante la prueba de aglutinación en lámina y siguiendo los criterios del Centro para el Control y Prevención de Enfermedades de Atlanta (CDC 2003). Para esto se utilizaron cepas controles positivos (cepas homólogas de referencia) y controles negativos (cepas heterólogas de referencia) suministradas por Instituto “Adolfo Lutz”-Brasil y por el Centro Venezolano de Colecciones de Microorganismos.
Los tres polivalentes presentaron una sensibilidad del 100%. Mientras que, la especificidad del polivalente I fue del 83% y la de los polivalentes II y III del 97%. Estos resultados muestran la óptima y alta especificidad de estos los polivalentes contra ECEP.
Posterior a la realización de las pruebas de sensibilidad, especificidad y estabilidad, se donaron pequeños lotes de estos sueros al Laboratorio de Microbiología del Hospital Vargas en donde fueron probados con resultados muy satisfactorios. De igual forma los sueros se han utilizado en varias tesis de grado; los resultados de una de estas tesis ya se han publicado (González et al., 2018).
Debido a la alta frecuencia de ECEP en los casos de diarrea infantil en nuestro país, la producción de los sueros aglutinantes para la identificación del patógeno es de gran importancia, siendo además que, por los momentos, representan la única oferta a nivel nacional, tienen una alta sensibilidad y especificidad y reducen considerablemente los costos de adquisición.
La producción de sueros aglutinantes para la identificación de ECEP, permitirá la identificación rápida y oportuna del patógeno lo que facilitará la aplicación de un tratamiento adecuado. De igual forma, se verá beneficiada la vigilancia epidemiológica de la enfermedad lo que llevará al desarrollo de medidas de prevención e intervención oportunas.
Venezuela tiene una ubicación geográfica privilegiada, ocupando una posición muy importante entre los países de América Latina (Albornoz 1996). Las características climatológicas y territoriales favorecen el desarrollo abundante de la flora, así como también de los agentes causales de las micosis profundas sistémicas, por lo que la incidencia de las enfermedades producidas por ellos, son de gran importancia en la salud pública (Pérez et al., 2000). Las micosis sistémicas, como la Histoplasmosis, Paracoccidioidomicosis y Aspergilosis están presentes en nuestro país, y se adquieren por inhalación. Actualmente, se requiere métodos de diagnóstico rápidos, de alta sensibilidad y especificidad y que contribuyan al conocimiento de su epidemiología. En este sentido, se han reportado, más de 1.600 casos anuales de micosis profundas que afectan a la población rural y urbana del país, siendo Histoplasma capsulatum, Paracoccidioides brasiliensis, Sporothrix schenckii, Coccidioides posadasii y Aspergillus spp los agentes causales más frecuentes (Vera et al., 2007, Martínez et al., 2013). La histoplasmosis es causada por Histoplasma capsulatum, posee una distribución mundial y se ha encontrado en los cinco continentes (Wheat et al., 2016). Por otro lado, la paracoccidioidomicosis, es una micosis sistémica, exclusiva de América Latina, es la primera micosis profunda en pacientes inmunocompetentes, es producida por Paracoccidioides brasiliensis y se caracteriza por estar asociada a la población rural (Cermeño et al., 2004; Martínez et al., 2013). Su diagnóstico tardío puede producir la muerte o conllevar a una importante fibrosis pulmonar (Da Silva et al., 2016).
La aspergilosis, es una micosis oportunista que afecta principalmente a individuos inmunocomprometidos (Vera et al., 2007). Es causada por Aspergillus spp, los cuales son hongos saprofitos y ubicuos, de distribución universal. En los últimos años, se observa un notable aumento de las infecciones micóticas, debido principalmente, a las condiciones socio-económicas de la población de las áreas endémicas de los países de Sur América, además, también se ha elevado el número de coinfecciones asociadas a micosis tales como: Tuberculosis y VIH. (Falci et al., 2019). En este sentido, el estudio micológico es certero y oportuno para el diagnóstico de estas micosis, pero el resultado tarda entre 15 a 30 días, mientras que el diagnóstico serológico, empleando antígenos fúngicos de producción endógena con cepas autóctonas, permite en una semana, un resultado que aunado a los parámetros clínicos, conforma un diagnóstico certero.
El laboratorio de Micología del Instituto de Biomedicina “Dr. Jacinto Convit”, ha venido desarrollando y caracterizando antígenos fúngicos para el diagnóstico de las micosis profundas localizadas y sistémicas desde los años 70, los métodos de producción fueron inicialmente tomados de trabajos de autores con experiencia en el área. Estos métodos se fueron adaptando y elaborando con cepas autóctonas, obtenidas de los pacientes afectados con cada una de las micosis. Se ensayaron cepas y técnicas hasta ir obteniendo reactivos de mayor calidad diagnóstica, comprobado su eficacia, especificidad y sensibilidad por diversas técnicas, a la par del diagnóstico micológico de rutina que siempre sustenta el estudio del paciente. Estos antígenos fúngicos, obtenidos de cepas autóctonas y sus respectivos antisueros específicos, permiten el diagnóstico de las micosis profundas y subcutáneas endémicas del país, a través del serodiagnóstico (Mendoza et al., 2002; Zambrano et al., 2001).
Hasta la fecha, estos reactivos se han elaborado a pequeña escala, por lo que no se pueden ofrecer de manera extensiva para ser distribuidos a nivel nacional a los múltiples centros de salud pública, donde son ampliamente requeridos. Viéndose éstos obligados (en el mejor de los casos) a adquirirlos de laboratorios comerciales, lo cual implica un alto costo, oen su defecto, prescindir de ellos. La elaboración enel país, a gran escala de los antígenos fúngicos concepas autóctonas, permitiría su distribución demanera eficaz y segura, a los centros de salud públicosespecializados en el diagnóstico de las patologíasfúngicas.
Además del diagnóstico, estos reactivos pueden servir de base para otros estudios de investigación, como la creación de cebadores moleculares para el diagnóstico molecular, desarrollo de futuras vacunas y tratamientos, permitiendo experimentar y desarrollar otras técnicas de diagnóstico serológico, de mayor sensibilidad y especificidad como por ejemplo la técnica de ELISA, la cual hasta la fecha, no está implementada en ningún centro de salud de nuestro país (Alvarado et al., 2015; Alvarado et al., 2020).
Principalmente, el desarrollo de estos reactivos en el país, brinda la oportunidad de poder crear y cubrir nuestras propias necesidades y requisiciones a costos factibles para el diagnóstico de las micosis endémicas y oportunistas que afectan a la población venezolana.
Helicobacter pylori (H. pylori) es una bacteria que coloniza la mucosa gástrica y se estima que más del 50% de la población mundial está infectada con esta bacteria, siendo que en países sub desarrollados la tasa de infección en la población sobrepasa el 80% (Zamani et al., 2018). La persistencia de la infección con H. pylori puede ocasionar el desarrollo de diversas patologías como gastritis, ulcera gástrica o duodenal, linfoma de tejido linfoide asociado a mucosa (MALT) y adenocarcinoma gástrico; por lo que es considerado el primer agente etiológico para la mayoría de los desórdenes gastroduodenales siendo declarado como agente carcinógeno humano tipo I en 1994, por la Organización Mundial de la Salud y la Agencia Internacional del Cáncer (IARC, 1994). La infección por H. pylori induce un proceso inflamatorio que produce gastritis crónica, la cual puede permanecer asintomática durante años o evolucionar desde una gastritis no atrófica a patologías gástricas severas (Correa 2012), es por ello que existe consenso a nivel mundial sobre la importancia de su diagnóstico y erradicación, la cual ha sido planteada como estrategia para la prevención de cáncer gástrico en el mundo (Malfertheiner et al., 2017).
H. pylori tiene alta variabilidad genética y sus genescagA y vacA le confieren mayor virulencia, siendo las cepas cagA+ las que están asociadas con mayor cronicidad de la infección, patologías gástricas severas y desarrollo de cáncer gástrico (Correa et al. 2012). En Venezuela, la infección gástrica por H. pylori es de alta prevalencia en niños y adultos, los estudios han demostrado que más de la mitad de la población está infectada, siendo que el 50% de los infectados lo están por cepas cagA+ (Bohórquez et al., 2010; Cavazza et al., 2004; Ortiz-Princz et al., 2003; Ortiz-Princz et al., 2016), por otro lado, nuestro país tiene una alta incidencia de cáncer gástrico, con énfasis en la zona Andina.
El diagnóstico de la infección es complejo, principalmente por la descrita inconsistencia entre las diferentes pruebas de diagnóstico disponibles, dicha inconsistencia está determinada por las diferencias de sensibilidad y especificidad, la calidad y precisión de la toma de muestra, la experticia del evaluador (examen histológico) y el tipo de prueba de diagnóstico utilizada. En general, las pruebas no invasivas están conformadas por la prueba de Carbono radiactivo (13C y 14C) también conocida como la prueba del aliento, la detección de antígenos en heces y la serología. De éstas, la primera es considerada la prueba de oro. Ninguna de las dos primeras detecta el tipo de cepa de acuerdo a sus factores de virulencia. Existen algunos estuches comerciales serológicos que detectan anticuerpos anti CagA, sin embargo ninguno de estos productos son elaborados en el país por lo que sus costos son muy elevados y por lo tanto poco accesibles, sobre todo en poblaciones de bajos recursos. Por su parte, las pruebas invasivas requieren la toma de biopsias gástricas a partir de las cuales se puede realizar el cultivo, la examinación histológica, PCR y la prueba de ureasa rápida. Estas pruebas se fundamentan en la detección directa de la bacteria, sus genes o productos metabólicos.
Es indiscutible que existe una gran necesidad de disponer de pruebas que contribuyan al diagnóstico de la infección y que además éstas determinen los factores de virulencia de la cepa infectante que son de importancia clínica, que sean pruebas de alta sensibilidad y especificidad, de costos accesibles y que den respuesta a los requerimientos existentes en el país. Cabe destacar que el adecuado diagnóstico de la infección y la detección de los factores de virulencia que están asociados al desarrollo de lesiones pre neoplásicas y neoplásicas, son esenciales para un diagnóstico certero y oportuno, así como para el adecuado seguimiento del paciente infectado, lo cual contribuye a la prevención de la cronicidad de procesos inflamatorios que pueden derivar en el desarrollo de cáncer gástrico.
El Laboratorio de Microbiología Molecular del Instituto de Biomedicina “Dr, Jacinto Convit”, tiene una amplia trayectoria en la investigación de la infección por H. pylori, así como de otros agentes infecciosos. Desde sus inicios, nuestro grupo de investigación trabajó en conjunto con el Laboratorio de Microbiología, donde bajo la orientación de la Dra. Urrestarazu y su equipo se estandarizaron los métodos para aislar y cultivar en 1983, por primera vez en Venezuela, a Campylobacter jejuni y posteriormente a H. pylori a partir de biopsias gástricas de pacientesinfectados (Vera 2008). A lo largo de su trayectoria, elLaboratorio de Microbiología Molecular hadesarrollado y ajustado protocolos para: el diagnósticomolecular de la bacteria y sus genes de virulencia, eldiagnóstico microbiológico, estudios desusceptibilidad antibacterianos y preparación deantígenos para el desarrollo y estandarización depruebas de diagnóstico basadas en la detección deanticuerpos, siempre en la búsqueda de herramientasque contribuyan a mejorar el diagnóstico de lainfección.
En los últimos años, nuestro grupo de investigación ha desarrollado una prueba diagnóstica basada en el diseño y síntesis de péptidos que permite determinar anticuerpos IgG séricos e IgA secretores en saliva específicos anti H. pylori y sus proteínas de virulencia, con lo cual es posible contribuir de esta manera al diagnóstico de esta infección, de una forma no invasiva. Resultados previos de nuestras investigaciones han mostrado que la detección de anticuerpos específicos anti H. pylori en saliva son un buen indicador de infección activa (Ortiz et al., 2002), por lo que su determinación en este formato es un gran aporte para el diagnóstico de la infección.
Con el apoyo del Centro Nacional de Proteómica del Instituto de Medicina Tropical, en los Laboratorios de Química de Proteínas, Síntesis de Péptidos y la Sección de Biohelmintiasis (Noya et al., 1998), se han diseñado secuencias de proteínas específicas de H. pylori utilizando herramientas de bioinformática y se han sintetizado estas secuencias peptídicas en fase sólida, lo cual nos ha permitido estandarizar pruebas de inmunodiagnóstico que determinan anticuerpos IgG séricos e IgA secretores en saliva, específicos anti péptidos de H. pylori, de CagA y otros factores de virulencia, en un formato de múltiples antígenos que permite evaluar varios péptidos de manera simultánea en la muestra de un paciente. Las pruebas han mostrado tener una alta sensibilidad y especificidad, la cual ha sido determinada utilizando como prueba de oro la PCR y se han empleado en diversos protocolos de investigación, con el apoyo de los Servicios de Gastroenterología de diferentes centros de salud nacional.
Estas pruebas se desarrollan a costos accesibles, son relativamente sencillas de realizar, se pueden usar masivamente y son una excelente alternativa no invasiva que junto al criterio clínico, dan respuesta al diagnóstico y contribuyen: al tamizaje, al criterio de decisión del estudio endoscópico de vías digestivas superiores y pautas de tratamiento, teniendo además un gran valor epidemiológico.
El desarrollo de estas pruebas de diagnóstico para la infección por H. pylori y sus factores de virulencia, basada en péptidos sintéticos, nace como una necesidad de dar respuesta al diagnóstico eficaz y oportuno de esta infección que es de alta prevalencia en Venezuela y cuya detección temprana contribuye a la prevención del cáncer gástrico.
Un resumen de los productos para el diagnóstico de las distintas enfermedades endémicas en Venezuela desarrolladas en la institución, en el marco de este proyecto, se muestran en la tabla 1.
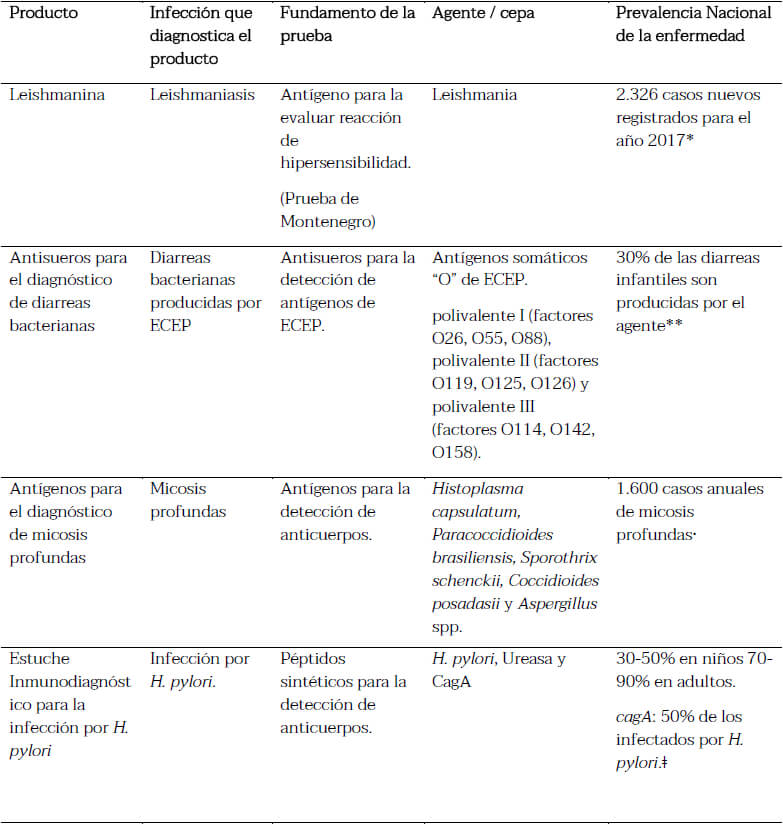
El desarrollo de los distintos productos para el diagnóstico de enfermedades endémicas en Venezuela aquí expuestos (Leismanina, antígenos para la detección de micosis sistémicas, antisueros para la detección de agentes bacterianos productores de diarreas y pruebas de inmunodiagnóstico para la detección de la infección por H. pylori y sus factores de virulencia), surge como una necesidad de dar respuesta a la limitación que genera la dificultad del diagnóstico y por consiguiente el tratamiento oportuno de las diferentes enfermedades. A pesar que los productos se han desarrollado previamente como parte de las líneas de investigación de nuestros laboratorios, y que se han elaborado con éxito a pequeña escala siendo probados en varios laboratorios nacionales, en trabajos de investigación publicados o presentados en congresos nacionales e internacionales y en tesis de grado, se hace necesario realizar los pasos requeridos y llevarlos a un formato adecuado que permita escalar su producción, distribución y mantenimiento en el tiempo, para así atender a las necesidades de diagnóstico nacional. Actualmente, estos productos dan respuesta a una cantidad importante de pacientes que acuden al Instituto a través del Servicio de Dermatología, el Hospital Vargas, el Hospital Universitario de Caracas, el Hospital Militar, entre otros centros nacionales del sistema público de salud.
El Instituto de Biomedicina “Dr. Jacinto Convit” cuenta con las capacidades y gran parte de la infraestructura necesaria, sin embargo requiere de una inversión importante para adecuar los espacios de la planta de producción existente y el laboratorio de control de calidad y poder cumplir así con las pautas y normas de Buenas Prácticas de Manufactura que permitan escalar la producción a un nivel superior para dar respuesta a la alta demanda de estos productos a nivel nacional.
La fortaleza de este proyecto de consolidar una planta de producción de los descritos productos biológicos para diagnóstico, reside en el conocimiento científico y la experiencia de su equipo de trabajo, en la infraestructura del Instituto de Biomedicina “Dr. Jacinto Convit” y en los saberes adquiridos para lograr el cumplimiento de la permisología nacional, las normas ISO, las Buenas Prácticas de Manufactura y el registro de marca. Siendo esta una innovadora visión dentro del Instituto, el cual desde sus inicios ha representado ser una institución de servicio, docencia e investigación.
Los productos de diagnóstico desarrollados en el Instituto de Biomedicina “Dr. Jacinto Convit”, son preparados con cepas autóctonas por lo que son altamente específicos para pacientes en Venezuela, tienen alta sensibilidad, representan la única oferta nacional, se producen a costos razonables y responden a una gran necesidad de diagnóstico en el país. Los diferentes grupos de investigación que conforman esta visión de la elaboración de productos para el diagnóstico de enfermedades endémicas en Venezuela, tienen un gran sentido de pertenencia con la institución y han logrado mantenerse en el tiempo a pesar de las adversidades, siguiendo el legado de cada uno de sus investigadores fundadores; innovando, dándole continuidad a las líneas de investigación, y adaptándolas a las necesidades actuales, uniendo esfuerzos con el objeto de proponer y desarrollar respuestas oportunas al país, basadas en el desarrollo científico.