Diversas investigaciones han documentado que en la leishmaniasis visceral canina (LVC), causada por Leishmania infantum/chagasi, el tratamiento con los fámacos convencionales no logra resolver la infección. Por lo tanto, es muy importante desarrollar nuevas estrategias en el tratamiento de la LVC para controlar la propagación de la enfermedad entre los perros y de los perros a los humanos. En el presente estudio, se analizó la respuesta de citocinas inducida por 5 secuencias de epítopes derivadas de p36/LACK de L. donovani, seleccionadas in sílico y sintetizadas en un estudio previo. La producción de IFN-γ, IL-6 y TNF-α se determinaron por ELISA en los sobrenadantes de cultivos de células mononucleares de sangre periférica de caninos naturalmente infectados sintomáticos (LVC) y perros sanos, estimulados in vitro en ausencia o presencia de fitohemaglutinina, antígenos crudos de L. donovani (Ld) y 5 péptidos sintéticos de la proteína p36/LACK. Los péptidos p36L02, p36L03 y p36L04 indujeron producción de IFN-γ (p<0,01). Mientras que una baja secreción de IL-6 se observó tras la estimulación con p36L01, p36L02 y p36L03. Los péptidos no estimularon a la producción de TNF-α en los cultivos linfocitario de los perros parasitados. Los resultados generales sugieren que los péptidos p36L02, p36L03 y p36L04 podrían ser buenos candidatos en el desarrollo de vacunas de segunda generación y/o inmunoterapia debido a la inducción de IFN-γ de protección.
Palabras clave: leishmaniasis visceral; caninos, citocinas; epitopes; p36/LACK; péptidos sintéticos.
Several investigations have documented that in canine visceral leishmaniasis (CVL), caused by Leishmania infantum/chagasis, conventional drug treatments fail to resolve the infection. Therefore, it is very important to develop new strategies of CVL treatment to control the spread of the disease between dogs and from dogs to humans. In the present study, we analyzed the cytokine response induced by 5 epitope sequences derived from L. donovani p36/LACK, selected in silico and synthesized in a previous study. The production of IFN-γ, IL-6 and TNF-α were determined by ELISA in supernatants of peripheral blood mononuclear cell cultures from symptomatic and naturally infected canines (CVL), stimulated in vitro with or without PHA, L. donovani (Ld) crude antigens and 5 synthetic peptides of the p36/LACK protein. Peptides p36L02, p36L03 and p36L04 induced IFN-γ, production (p<0.01). While a low IL-6 secretion was observed after stimulation with p36L01, p36L02 and p36L03. The peptides did not stimulate the production of TNF-α in the lymphocyte cultures of the parasitized dogs. Overall results suggest that the peptides p36L02, p36L03 and p36L04 might be good candidates in the development of second-generation vaccines and/or immunotherapy due to the induction of protective IFN-γ.
Key words: Visceral leishmaniasis; canines; cytokines; epitopes; p36/LACK; Synthetic peptides.
La leishmaniasis visceral (LV) es una parasitosis severa causada principalmente por L. (L) donovani y L. (L) infantum (sinónimo L. chagasi). Esta enfermedad puede ser letal si no es diagnosticada y tratada a tiempo. Estudios previos han demostrado que en múridos infectados con L. (L) donovani y caninos infectados con L. (L) infantum, la resistencia frente al parasito se asocia con el predominio de citocinas proinflamatorias tales como el IFN-γ, TNF-α, caracterís tico a respuestas inmunitarias de tipo CD4 +Th1, por otro lado, se ha asociado susceptibilidad frente al parásito cuando se desarrollan respuestas de tipo CD4+Th2 (Kaye y Scott, 2011; Nieto et al., 2011).
En Venezuela la LV, representa un problema de salud pública debido a la gran distribución que esta posee en nuestro país, donde el Estado Nueva Esparta es el foco endémico más estudiado (Lugo et al., 2015; Zerpa et al., 2003a). Diferentes trabajos han mostrado que los perros son uno de los principales reservorios domésticos y peridomésticos del parásito, éstos son fuente importante de infección para el vector, representando un alto potencial de riesgo para los humanos debido a la estrecha relación entre humanos y perros (Okuno et al., 2002; Silva, 2008).
El tratamiento con quimioterapia para la LV canina es poco efectivo debido a la resistencia a los medicamentos, la toxicidad y el incumplimiento (Baxarias et al., 2019; Maia et al., 2010; Uliana et al., 2018). De ahí la importancia en investigar nuevas alternativas terapéuticas tales como vacunas o inmunoterapias, siendo los métodos preventivos más confiable y rentables, para tratar de evitar o minimizar la transmisión del parasito entre caninos y humanos (Baxarias et al., 2019; Ghorbani y Farhoudi, 2018; Gonçalves et al., 2019; Singh y Sundar, 2014). En ese sentido, el antígeno p36/LACK es de particular interés como un candidato para vacuna debido a lo siguiente: tiene un rol predominante en la inmunopatogénesis de la infección; la secuencia aminoacídica de 36kDa LACK es altamente conservada en amastigotes y promastigotes de diferentes especies de Leishmania, es un análogo del receptor de la kinasa C preactivada (PKC), la cual tiene importantes funciones como mediador de las interacciones entre proteínas activadoras y/o señalizadoras (Okuno et al., 2002). Algunos estudios han mostrado que la p36/LACK induce protección contra Leishmania, a través de la inmunización con ADNp36/LACK seguido de una re-inmunización con virus vaccinia-p36/LACK induciendo activación de respuesta de células T y protección contra Leishmania, en múridos (Dondji et al., 2005; Gomes et al., 2007) y perros (Ramiro et al., 2003; Ramos et al., 2008). En otro estudio, la inmunización intranasal de hámsteres con LACK ADN activó el desarrollo de una respuesta inmune que le permitió a estos animales resistir un reto con L. (L) chagasi (De Oliveira Gomes et al., 2011). Sin embargo, en caninos poco se conoce del posible rol protector de la p36/LACK y su potencial uso en el desarrollo de inmunoterapias para estos animales, por eso nos propusimos evaluar en linfocitos de perros con LVC, la respuesta de citocinas pro-inflamatorias luego de estimulación con cinco determinantes antigénicos derivados de la p36/LACK, identificados previamente por nosotros (Terán-Angel et al., 2007).
Los péptidos sintéticos derivados de la proteína p36/LACK de L. donovani evaluados, fueron los siguientes: p36L01 (97-114 GQCQRKFLKHTKDVLAVA), p36L02 (129-152 VIRVWNVAGECMHEFLRDGHEDW), p36L03 (171-188 SWDNTIKVWNVNGGKCER), p36L04 (184-199 GKCERTLKGHSNYVSTV) y p36L05 (292-309 NTLYSGHKDNLIRVWSIS). Los mismos fueron identificados previamente por nosotros (Terán-Angel et al., 2007). Fueron sintetizados en fase sólida y purificados (>90%) mediante cromatografía líquida de alta resolución (HPLC por sus siglas en inglés) por el laboratorio de Síntesis de Péptidos del Instituto de Medicina Tropical, Facultad de Medicina – UCV, Venezuela.
Se estudiaron 24 perros domésticos con infección natural por L. infantum/chagasi provenientes de zonas endémicas de la Isla de Margarita (estado Nueva Esparta, Venezuela) y 12 caninos clínicamente sanos, del bioterio de la Escuela de Medicina José María Vargas (UCV).
Los caninos se seleccionaron acorde a la presencia de tres o más signos clínicos: pérdida de peso, opacidad corneal, onicogrifosis, alopecia, úlceras cutáneas, hepatoesplenomegalia y ganglios linfáticos palpables (Alvar et al., 2004). Posteriormente, el diagnóstico de Leishmaniasis visceral canina (LVC) fue confirmado en el Laboratorio de Leishmaniasis de la Corporación de Salud (CORPOSALUD) del MPPS (estado Nueva Esparta, Venezuela), mediante el método serológico con rK39, (kinesina de L. infantum/chagasi, epítope inmunodominante reconocido por linfocitos B) (Badaró et al., 1996; Braz et al., 2002; Terán-Ángel et al., 2010). Método de alta sensibilidad y especificidad utilizado de rutina en Venezuela para la confirmación del diagnóstico de LV humana y canina (Zerpa et al., 2003b).
La manipulación de los animales, se llevó a cabo siguiendo los lineamientos del Código de Ética para la Vida del MPPCTI (Código de Ética para la Vida, 2010), capitulo 3 y aprobado por el Comité de Bioética del Instituto de Biomedicina UCV-MPPS. La recolección de datos y muestras biológicas de los perros fueron realizados bajo consentimiento informado de sus dueños.
Se tomaron muestras de sangre periférica por venopunción a 24 perros con LVC y 12 perros sanos incluidos en el estudio (rK39 negativos), para la obtención de suero y cultivo in vitro de células mononucleares.
Células mononucleares de sangre periférica (PBMC), fueron aisladas de 20 mL de sangre venosa heparinizada de perros con LVC y perros sanos mediante la modificación de un protocolo descrito previamente (Ramayo et al., 2005). Brevemente, se realizó un gradiente de densidad con Lymphoprep™ (STEMCELLTM) y con sangre heparinizada, diluidas 1:1 en solución de PBS estéril pH 7,2 a 400g durante 20 min. El halo enriquecido con células mononucleares se colectó y lavó tres veces en PBS, Las células obtenidas se suspendieron en RPMI 1640 (Gibco, USA) suplementado con 10% de suero fetal bovino y 100 U/mL de penicilina y 100 μg/mL de estreptomicina (Gibco®), Las células fueron dispensadas por triplicado para cada condición experimental, en placas fondo plano estériles de 96 pozos (Nunc Thermo Scientific) a una concentración de 2 x 105 células/pozo y se estimularon con 20 μg/mL de p36L01, p36L02, p36L03, p36L04, p36L05, fitohemaglutinina (PHA; 1 μg/pozo), antígeno crudo de Leishmania donovani (MHOM/IN/80/DD8) 2 x 105 parásitos/pozo o solo medio RPMI suplementado. Las placas fueron incubadas a 37ºC y 5% CO2. A los 3 días, se colectaron 100 μL/pozo de sobrenadante para la condición de estimulación con fitohemaglutinina y a los 5 días para los cultivos estimulados con L. donovani y los péptidos bajo estudio, se almacenó a 70ºC para posterior evaluación de citocinas.
Las concentraciones de IFN-γ, TNF-α e IL-6 en los sueros y sobrenadantes de los cultivos linfocitarios de los perros con LVC y sanos, se determinaron mediante ELISA de captura comerciales siguiendo las instrucciones del fabricante (R&D Systems, MN, USA). Las concentraciones de cada citocina se obtuvieron a partir de una curva patrón construida con recombinante de cada citocina suministradas por los kits (Canine TNF-α DuoSet®, sensibilidad: 15,6 - 1000 ρg/mL; Canine IFN-γ, DuoSet®, sensibilidad: 31,2 - 2000 ρg/mL; Canine IL-6 DuoSet®, sensibilidad: 62,5 - 4000 ρg/mL; R&D Systems, MN, USA). Los resultados fueron expresados en ρg/mL.
Las diferencias entre los grupos para cada parámetro evaluado fueron establecidas mediante el test de Mann-Whitney. Las comparaciones fueron consideradas significativas cuando p<0,05. Para los análisis se usó el programa Prism 5 para Windows, versión 5.01 (GraphPad Software, Inc. 2007).
Para estudiar la inmunogenicidad de los péptidos, se decidió previamente evaluar el estado inmunológico de los perros bajo estudio (LVC y sanos), para ello se les determinaron las concentraciones séricas de IFN-γ, TNF-α e IL-6 (Figura 1).
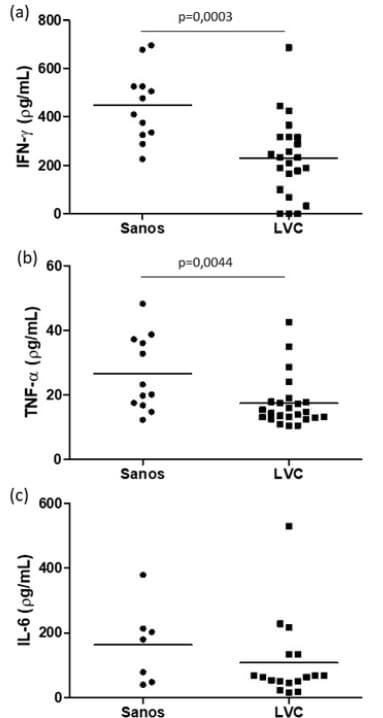
En los perros enfermos se evidenció una menor (p<0,05) concentración de IFN-γ (228,82 ± 163,69 ρg/mL) y de TNF-α (17,37 ± 7,85 ρg/mL) respecto a lo encontrado en los perros sanos: 447,8 ± 147,49 ρg/mL para IFN-γ y 26,45 ± 11,6 ρg/mL para TNF-α (Figura 1a y 1b). En contraste, no evidenciamos diferencias significativas en la concentración sérica de IL-6, entre ambos grupos de caninos (Figura 1c).
La figura 2 muestra la concentración (ρg/mL) promedio + desviación estándar de IFN-γ, TNF-α e IL-6 en respuesta al mitógeno PHA, en los cultivos linfocitarios de los caninos sintomáticos y sanos. Las células de los perros sanos produjeron mayores (p<0,05) concentraciones de IFN-γ y TNF-α en respuesta a la PHA (44,4 ± 25,7 ρg/mL; 203,8 ± 74,5 ρg/mL; respectivamente) comparado con lo encontrado en los perros con LVC (10,8 ± 8,0 ρg/mL; 72,6 ± 20,2 ρg/mL; respectivamente). Mientras que, la IL-6 detectada en los sobrenadantes de los cultivos celulares de los perros infectados (58,6 ± 21,6 ρg/mL) estuvo incrementada significativamente (p<0,05) comparado con los perros sanos (34,2 ± 29,9 ρg/mL).
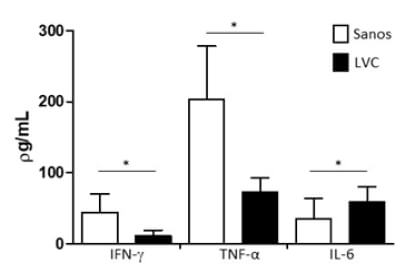
La respuesta de citoquinas IFN-γ, TNF-α e IL-6 luego estimulación de las PBMC de caninos sintomáticos y controles sanos con antígeno crudo de Ld o los péptidos epítopes de p36/LACK se representa en la figura 3. Los perros con LVC mostraron una disminución de TNF-α y un incremento IL-6 significativos luego de estimulación con Ld comparado con lo observado en los perros sanos.
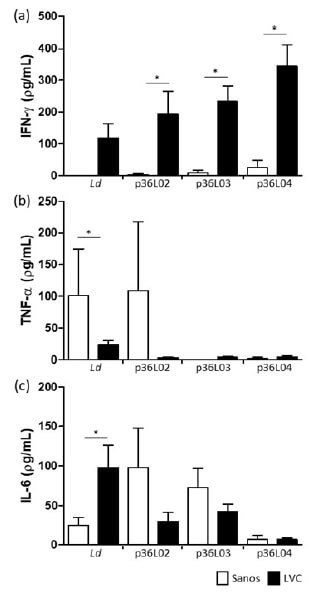
Los péptidos de p36/LACK indujeron una respuesta de citocinas en más del 20% de la población de los perros con LVC y sanos. Interesantes resultados obtuvimos con tres de ellos (p36L02, p36L03 y p36L04), cuya respuesta de IFN-γ en los caninos infectados p36L02 (194,0 ± 70,7 ρg /mL), p36L03 (233,6 ± 49,3 ρg /mL) y p36L04 (344,8 ± 68,3 ρg /mL), fue significativamente mayor (p<0,05) que la obtenida en respuesta al antígeno crudo de Ld (117,4 ± 45,6 ρg / mL) (Figura 3a). Más aun, la respuesta de IFN-γ asociada a estas secuencias (p36L02, p36L03 y p36L04) resultó ser mucho mayor (p<0,01) en los perros infectados comparado con los sanos.
En la Figura 3b, se puede apreciar que en los perros con LVC, estos péptidos no indujeron producción de TNF-α, en contraste a lo observado previamente bajo el estímulo con Ld (23,6 ± 6,4 ρg /mL). Adicionalmente, respecto a la IL-6, demostramos que a diferencia de lo obtenido en los cultivos estimulados con Ld para perros infectados, los péptidos p36L02, p36L03 y p36L04 no indujeron una producción importante de esta citocina. Finalmente, los péptidos p36L01 y p36L05 no indujeron una producción significativa de las citocinas estudiadas (datos no mostrados).
Es conocido que en leishmaniasis visceral, la principal respuesta protectora frente al parásito Leishmania, es inducida principalmente por la respuesta inmune de tipo CD4+ Th1, caracterizada por la producción de IFN-γ y TNF-α. Este tipo de respuesta está relacionada con la regulación positiva de la actividad leishmanicida en los macrófagos (Gonçalves et al., 2019; Koutinas y Koutinas, 2014), principal mecanismo efector de la muerte intracelular de los amastigotes de Leishmania (Barbiéri, 2006; Scott y Novais, 2016). En este sentido, el IFN-γ y el TNF-α, son predominantes en perros asintomáticos, lo que demuestra su potencial protector contra la enfermedad (Costa-Pereira et al., 2015; Rodríguez et al., 2010).
Los perros incorporados en nuestro estudio, con diagnostico confirmado de LVC por criterios clínicos y la seropositividad a la prueba con rK39, también presentaron pobres niveles serológicos de IFN-γ y TNF-α. Resultados similares se han reportado en otras investigaciones, en las cuales se ha evidenciado que los perros con baja respuesta de estas citocinas (IFN-γ y TNF-α) presentaban sintomatología clínica (Barbiéri, 2006; Boggiatto et al., 2010; Rodríguez et al., 2010) con una mayor parasitemia (Martínez-Orellana et al., 2017; Solano-Gallego et al., 2009). Estos estudios, tampoco encontraron diferencias en las concentraciones serológicas de IL-6 en perros con LVC (Rodríguez et al., 2010).
Con relación a las respuestas in vitro, se ha observado en caninos, que los linfocitos de animales polisintomáticos con LVC estimulados con antígenos crudos de Leishmania spp producen concentraciones bajas de IFN-γ, IL-18, TNF-α e IL-10, lo cual concuerda con nuestros hallazgos (Carrillo y Moreno, 2009). En estos estudios también han reportado, concentraciones significativas de IL-6 en respuesta a los estímulos específicos ya mencionados (Dayakar et al., 2019). Nuestra investigación reprodujo estas observaciones: las células mononucleares de caninos con LVC mostraron una mayor producción de IL-6 en respuesta a la PHA y al antígeno crudo de L. donovani. Lo cual indica que la baja producción de citocinas proinflamatorias junto a los elevados niveles de IL-6 está vinculada con la progresión de la enfermedad.
Estudios con p36/LACK han demostrado que es esencial para la viabilidad del parásito y para su establecimiento en el huésped.
La respuesta inmunológica a esta molécula ha sido estudiada y utilizada para estudios experimentales de vacunas (De Oliveira Gomes et al., 2011; Dondji et al., 2005; Ramiro et al., 2003; Ramos et al., 2008), también se ha utilizado como herramienta para investigar mecanismos relacionados con inmunidad y se ha ensayado en varios experimentos de inmunización, proporcionando resultados heterogéneos (Alcolea et al., 2019; Evans y Kedzierski, 2012).
Mediante el análisis in silico de p36/LACK de L donovani, (99% homologa con la de L. infantum/chagasi especie infectante de los caninos estudiados) hemos seleccionado 5 péptidos epítopes, en un estudio previo. Estos péptidos constituyen epítopes T ya que tienen estructura α- hélice anfipática con patrones repetitivos conocidos por unirse a las moléculas del complejo principal de histocompatibilidad (MHC) de clase I y II (Terán-Ángel et al., 2007).
En el presente estudio, evidenciamos que tres de los cinco péptidos, pudieron ser reconocidos por los linfocitos T de los caninos sintomáticos y activarlos. Como lo refleja la producción de IFN-γ asociada a las secuencias p36L02, p36L03 y p36L04, que resultó ser mucho mayor en los perros infectados que en los sanos. Esto sugiere que estos péptidos son epítopes inmuno-dominantes dentro de la molécula p36/LACK, involucrados en el desarrollo de una respuesta mediada por células T, que incluye la estimulación y proliferación de células productoras de citocinas como IFN-γ, que potenciaría la actividad anti-Leishmania mediada por radicales de oxígeno y el óxido nítrico, esenciales para la protección y/o curación de la LV (Dias et al., 2018; Reed et al., 2016; Singh y Sundar, 2014).
Con respecto al TNF-α, no encontramos una producción importante de esta citocina en los cultivos linfocitarios de perros con LV al estimularlos con el antígeno crudo de Ld y los 5 péptidos. El TNF-α junto con el IFN-γ, se asocian con respuestas Th1, por lo que esperábamos una respuesta similar a la obtenida con el IFN-γ, sin embargo, esto no fue así. Probablemente el TNF-α pudo haberse producido tempranamente y para el momento en que se colectaron los sobrenadantes de los cultivos estimulados con Ld y péptidos, éste podría haberse consumido.
Ninguno de los péptidos indujo una producción evidente de IL-6, resultado alentador puesto que esta citocina se ha relacionado con la progresión de la enfermedad en humanos y caninos (Dayakar et al., 2019).
Las vacunas clásicas contra la leishmaniasis han estado basadas en el uso de parásitos atenuados o subunidades del mismo, lo cual es desventajoso porque consisten en un amplio rango de determinantes antigénicos capaces de activar respuestas protectoras o respuestas inadecuadas. En contraste, el uso de péptidos en vacunas e inmunoterapias tiene varios beneficios como lo son: buena estabilidad, ausencia de toxicidad, baja complejidad y bajo costo. Por lo cual, si se acompaña de un adjuvante apropiado puede ser de utilidad en el desarrollo de una vacuna terapéutica (De Brito et al., 2018).
En conclusión, estos resultados sugieren el potencial inmunogénico de estos péptidos: p36L02, p36L03 y p36L04, los cuales pudieran ser considerados como base en el desarrollo de terapias alternativas por asociarse con una alta producción de IFN-γ por los linfocitos de los perros con LVC, que podría contribuir con su recuperación.
Agradecemos a la Dirección Regional de Salud del Estado Nueva Esparta, Coordinación de Zoonosis por el apoyo en la selección de los perros y a la Lic Melcenia Moreno por el transporte de las muestras a Caracas. Este trabajo recibió el financiamiento del CDCH-UCV y el FONACIT proyecto grupal N° G2005000375.