El tratamiento de primera línea contra la Leishmaniasis consiste en la administración de antimoniales pentavalentes, los cuales producen efectos secundarios indeseados e incluso, altamente nocivos. Además, son varios los reportes de generación de resistencia a estas drogas por parte del parásito, lo que ha llevado a la evaluación de terapias alternativas dentro de las que destaca el uso de plantas y/o sus principios activos. En el presente trabajo se reportan los resultados preliminares sobre el efecto del extracto de Artemisia annua L. en las especies L. (V) braziliensis y L. (L) mexicana prevalentes en Venezuela, así como en parásitos L. (V) braziliensis resistentes al Glucantime. Los parásitos fueron cultivados en medio bifásico agar base sangre. Se probaron varias concentraciones del extracto vegetal, entre 10 y 30 mg, procesado en agua destilada estéril mediante sonicación y esterilizado en autoclave. Se observó la reducción del número de parásitos aún con la concentración más baja, respecto a lo registrado en los controles. También se observó efecto antileishmania en los parásitos resistentes al Glucantime. Estos resultados señalan la utilidad potencial de esta planta en el tratamiento de la Leishmaniasis asociada a L. (V) braziliensis y L. (L) mexicana e incluso, en casos resistentes al Glucantime. A futuro, es importante realizar pruebas con un rango más amplio de concentraciones del compuesto, tanto in vitro como en modelos murinos.
Palabras clave: Leishmaniasis; Leishmania braziliensis; Artemisia annua; efecto parasiticida.
The first-line treatment against Leishmaniasis consists in the administration of pentavalent antimonial, which produce unwanted and even highly harmful side effects. On the other hand, there are several reports of the generation of resistance to these drugs by the parasite, which has led to the evaluation of alternative therapies, highlighting the use of plants and / or their active ingredients. Here we report the results of a preliminary study on the effect of the extract of Artemisia annua L. in L. (V) braziliensis and L. (L) mexicana, prevalent species in Venezuela, as well as in parasites of L. (V) braziliensis Glucantime-resistant. The parasites were grown in biphasic blood-based agar medium. Several concentrations of the plant extract, between 10 and 30 mg, were tested, processed in sterile distilled water by sonication and sterilized by autoclave. We observed the reduction in the number of parasites even with the lowest concentration, compared to that recorded in the controls. Anti-Leishmania effect was also observed in Glucantime resistant parasites. These results indicate the potential utility of this plant in the treatment of Leishmaniasis associated with L. (V) braziliensis and L. (L) mexicana and, even, in cases resistant to Glucantime. In the future, it is important to perform tests with a wider range of concentrations of the compound, both in vitro and in murine models.
Key words: Leishmaniasis; Leishmania braziliensis; Artemisia annua; parasitical effect.
El género Leishmania agrupa 21 especies conocidas de parásitos intracelulares dimórficos, patogénicas al hombre, responsables de la Leishmaniasis, parasitosis endémica en grandes áreas tropicales, subtropicales y en la cuenca del Mediterráneo, con manifestaciones clínicas diversas que incluyen la Leishmaniasis Cutánea, la Leishmaniasis Mucosa y la Leishmaniasis Visceral (Akhoundi et al., 2017).
En las Américas, entre 2001 y 2017, un total de 940.396 nuevos casos de Leishmaniasis Cutánea y Mucosa fueron reportados por 17 de los 18 países endémicos, con un promedio anual de 55.317 casos (OPS, 2019). Según De Lima et al. (2010, 2011), en Venezuela la Leishmaniasis Cutánea abarca todo el territorio nacional con el 97,93% de los casos de Leishmaniasis reportados entre 1998 y 2009, registrándose un número total de 52.282 casos y una tasa de incidencia que disminuye progresivamente a partir del año 2003 de 11,8 x 100.000 habitantes a 7,94 x 100.000 habitantes en 2009; los autores destacan la existencia de un subregistro notable de los casos. La especie identificada con mayor frecuencia es L. (V) braziliensis, relacionada con la Leishmaniasis Cutánea, seguida por L. (L) amazonensis y L. (L) mexicana, con una frecuencia muy baja, relacionadas generalmente a la forma difusa de la enfermedad que representa el 0,06% de todos los casos de Leishmaniasis en Venezuela (Zerpa y Convit, 2009).
Debido a que existen varias manifestaciones clínicas de la parasitosis relacionadas a distintas especies del parásito, con un amplio espectro de sensibilidad a los fármacos disponibles, se han desarrollado diversos tratamientos que incluyen terapias físicas, vacunas, compuestos naturales y quimioterapia con drogas convencionales de las cuales las más utilizadas mundialmente son los antimoniales pentavalentes. Las principales limitaciones de estas drogas son su toxicidad para el paciente y el eventual desarrollo de resistencia por parte de parásito (Layegh et al., 2009, Peláez, 2012).
Dentro de los compuestos naturales para el tratamiento de la Leishmaniasis se ha probado la artemisina o artemisinina, extraída de Artemisia vulgaris y Artemisia annua, la cual ha sido efectiva en estudios in vitro donde se aplicaron concentraciones micro molares contra promastigotes y amastigotes de L. donovani infectando macrófagos de ratón, destacando que no hubo efecto en la viabilidad de los macrófagos. La ausencia de efectos citotóxicos también se observó en estudios con la línea celular humana U937 y la Raw 264.7 de ratón. Igualmente, se ha reportado la reducción de lesiones plantares en ratones BALB/C infectados con L. major, asociada a la disminución de la carga parasitaria. Otros compuestos aislados de Artemisia sp. evaluados para tratar la Leishmaniasis son el “artemether” (arteméter) y el artesunato, de los cuales solo el primero tuvo efecto leishmanicida, aunque con menor potencia que la artemisina (Avery et al., 2003; Yang et al., 1993; Islamuddin et al., 2014; Mesa et al., 2017).
Así mismo, se ha evaluado el efecto del polvo de la hoja de esta planta en modelos in vitro e in vivo, observándose la reducción de la carga parasitaria y del tamaño de lesiones cutáneas no complicadas asociadas a L. (V) panamensis (Mesa et al., 2017).
Los estudios con esta planta para el tratamiento de la Leishmaniasis son prometedores y en general se han realizado con las especies L. major y L. donovani del Viejo Mundo y con L. (V) panamensis del Nuevo Mundo. En Venezuela, la especie prevalente es L. (V) braziliensis y, tomando en cuenta las variaciones de susceptibilidad ante distintos enfoques terapéuticos por parte de las distintas especies del parásito, es importante estudiar la acción de esta planta sobre la mencionada especie.
En este sentido, el presente trabajo tuvo como objetivo la evaluación del efecto del extracto de la hoja de Artemisia annua L. en el crecimiento in vitro de promastigotes L. (V) braziliensis y L. (L) mexicana, especies prevalentes a nivel nacional. Considerando que los antimoniales pentavalentes Glucantime® y Pentostam® son los medicamentos de primera línea usados mundialmente en el tratamiento anti-Leishmania, se comparó el efecto del extracto vegetal con el del Glucantime®.
Parásitos: Se utilizaron dos cepas de Leishmania spp.: L. (V) braziliensis (MHOM/BR/75/M2903) y L. (L) mexicana (MHOM/BZ/82/BEL21).
Medios de cultivo: Los promastigotes de las cepas del parásito fueron cultivados en medio bifásico Base de Agar Sangre (GIBCO) y medio líquido.
Efecto de Artemisia annua L. sobre el crecimiento in vitro de los parásitos. Para evaluar el efecto del extracto vegetal en el crecimiento in vitro de las cepas de Leishmania, se colocó un millón de parásitos (promastigotes) en placas de Petri con base de agar sangre más 2 mL de medio líquido. Se probaron 4 concentraciones del extracto vegetal: 10, 15, 20 y 30 mg, evaluando su efecto en el crecimiento, para lo cual se contó el número de parásitos vivos a las 72 horas después de iniciado el ensayo (al comienzo de la fase exponencial de crecimiento), utilizando coloración con azul tripano en cámara de Neubauer. Igualmente, se realizaron controles de parásitos creciendo en ausencia del extracto. Cada prueba con los controles y con las distintas concentraciones del extracto para las dos cepas de parásitos, se realizó por triplicado.
Efecto del Glucantime sobre el crecimiento in vitro de los parásitos. El crecimiento de los parásitos en presencia del extracto vegetal se comparó con el crecimiento observado en presencia del Glucantime®, fármaco de referencia en el tratamiento de la Leishmaniasis. Para ello, se colocaron 1x106 parásitos en placas de Petri con el medio de cultivo bifásico, incorporando 40 μg/mL de la droga (Sanofi-Aventis), correspondiente a la dosis terapéutica reportada por distintos investigadores. Se determinó el número de parásitos en cámara de Neubauer mediante tinción con azul tripano, a las 72 horas de iniciar el ensayo, el cual se realizó por triplicado.
Efecto de Artemisia annua L. sobre el crecimiento in vitro de parásitos resistentes al Glucantime. La resistencia al Glucantime® se obtuvo gradualmente, agregando concentraciones crecientes del fármaco a promastigotes de L. (V) braziliensis en cultivo durante los repiques semanales. La dosis se duplicó cada dos semanas, iniciando con 10 μg de Glucantime® por cada mL del medio de cultivo, hasta alcanzar la concentración de 3,9 mg/mL, correspondiente a 200 veces la dosis terapéutica, aproximadamente. Estos parásitos se cultivaron en presencia de la dosis mencionada de Glucantime y de 10, 20 y 30 mg del extracto de Artemisia annua L., tal como se indica en la prueba del efecto del compuesto vegetal en el crecimiento in vitro de Leishmania sensible al fármaco. Se realizó un control con parásitos creciendo solo en presencia del antimonial y otro control con parásitos creciendo en presencia de 7,5 μg/mL de Anfotericina B, otro compuesto usado para el tratamiento de la Leishmaniasis. El ensayo se realizó por triplicado.
Una vez contados los parásitos, se calculó el promedio del número de células obtenido en las tres réplicas realizadas. Estos datos se reportaron en la figura 1.
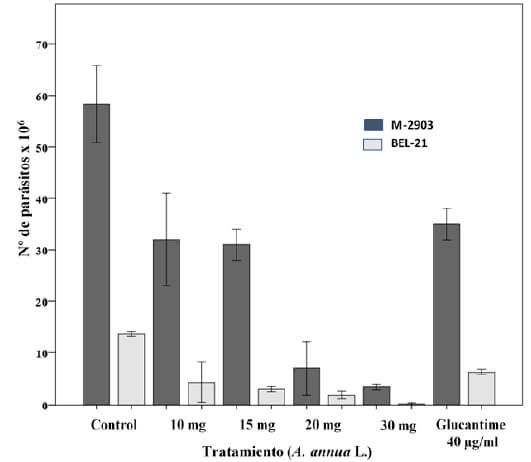
Como se observa en esta figura, el extracto vegetal tuvo un efecto dependiente de la concentración sobre el crecimiento de los parásitos. La comparación entre el número de células en los cultivos recibiendo tratamiento y el de los controles pone en evidencia una acción inhibitoria al aplicar la concentración más baja del extracto (10 mg), con aproximadamente la mitad de parásitos respecto a los reportados en los controles. La concentración más alta (30 mg) ocasionó la reducción de aproximadamente 90% en el crecimiento de los parásitos para la cepa M2903 con respecto al crecimiento observado en los controles, mientras que para la cepa BEL 21 esta concentración produjo la muerte del 70% de los parásitos sembrados inicialmente, lo que parece indicar una mayor sensibilidad frente al extracto vegetal para esta cepa respecto a la cepa M2903.
Para probar el efecto de A. annua L. sobre parásitos resistentes al Glucantime, promastigotes de M2903 resistentes a este fármaco se cultivaron en presencia de 10, 20 y 30 mg del extracto vegetal. Los resultados de esta prueba se muestran en la tabla 1 y la figura 2, observándose que dicho extracto, a la concentración más baja probada, redujo en aproximadamente un 50% la población de parásitos con respecto al control (cultivo en ausencia del extracto).

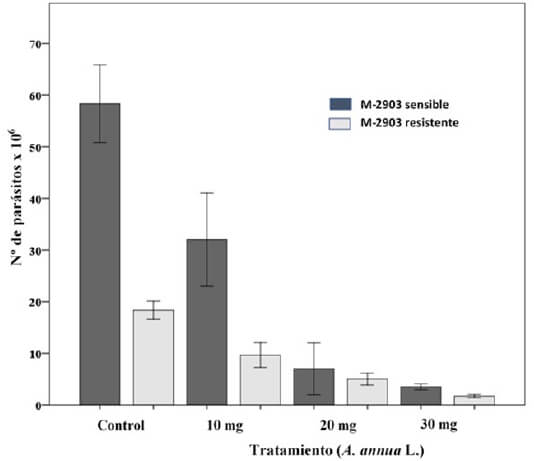
El efecto inhibitorio es dependiente de la concentración, observándose que a la más alta prácticamente no hubo crecimiento y que el número de parásitos fue similar al obtenido con Anfotericina B. Este resultado es interesante debido a los reportes de pérdida de sensibilidad a antimoniales durante el tratamiento de pacientes con Leishmaniasis, ya que sugiere que la artemisa es una opción para terapia en esta situación, con menos costos y efectos nocivos que otras drogas comerciales como la Anfotericina.
Desde hace más de 5 décadas los antimoniales pentavalentes bajo los nombres comerciales Glucantime® y Pentostam®, son los medicamentos de primera línea usados en el tratamiento de distintas manifestaciones clínicas de la Leishmaniasis. Químicamente son similares y su toxicidad y eficacia están relacionadas con el contenido de antimonio Sb5 +: la solución de antimoniato de meglumina contiene un 8,1% (81 mg/mL), mientras que la solución de estibogluconato de sodio contiene un 10% (100 mg/ mL). En la literatura se reportan dosis entre 20 y 120 mg/kg de peso, generalmente durante 20 días, para el tratamiento de las distintas manifestaciones clínicas de la Leishmaniasis (Henao et al., 2004). Sin embargo, se ha reportado la aparición de resistencia por parte del parásito, además de que causa efectos adversos que incluyen anorexia, vómitos, náuseas, dolor abdominal, malestar, mialgias, artralgias, cefaleas, sabor metálico y letargo; esto ha llevado a la búsqueda de tratamientos alternativos y nuevas drogas menos dañinas al paciente para tratar la enfermedad. Una de estas alternativas consiste en el uso de la planta Artemisia annua L. o sus derivados y principios activos purificados, la cual, inicialmente, se ha usado con éxito para tratar el paludismo, incluso resistente a la cloroquina, y luego en estudios de Leishmaniasis con las especies L. major, L. donovani y L. (V) panamensis, incluyendo modelos murinos, pacientes y cultivo in vitro de promastigotes y de amastigotes en macrófagos de ratón y líneas celulares humanas. En estos estudios se ha destacado una alta efectividad y la ausencia de efectos secundarios en los animales experimentales, en los macrófagos y en las personas. Hasta ahora, se han identificado dos compuestos presentes en Artemisia sp. con actividad leishmanicida, la artemisinina y el arteméter, siendo el primero más efectivo que el segundo (Avery et al., 2003, Yang et al., 1993, Mesa et al., 2017). En cuanto al mecanismo de acción de este compuesto en kinetoplastidas, particularmente en Tripanosoma cruzi y Tripanosoma brucei rhodesiense, la artemisinina inhibió el crecimiento in vitro y la actividad ATPasa calcio- dependiente de las membranas de los parásitos, lo que sugiere un efecto vía bombas de membrana (Mishina et al., 2017). En amastigotes intracelulares de L. donovani, el efecto inhibitorio de aceites esenciales de A. annua se relacionó con el mecanismo de muerte celular programada (Islamuddin et al., 2014). Unido al efecto leishmanicida, se ha observado que A. annua estimula la respuesta inmune Th1 (Islamuddin et al., 2015).
Para este estudio preliminar sobre el efecto de A. annua L. en especies de Leishmania prevalentes en Venezuela, se usó el extracto vegetal completo obtenido de la maceración en agua destilada estéril del polvo de las hojas de la planta. En otros trabajos, este polvo ha sido disuelto en presencia de compuestos orgánicos, especialmente DMSO (con reportes controversiales de su toxicidad y efectos adversos en el organismo, incluyendo alergias), y se han probado fracciones del procesamiento con distintos alcoholes. Para este trabajo, el polvo de las hojas de A. annua se disolvió solo en agua, líquido vital inocuo, sin efectos adversos, lo que sería ventajoso en el uso de este vegetal como terapia contra la Leishmaniasis, reduciendo costos de procesamiento y riesgos a la salud. En cuanto al uso del polvo completo de hojas en lugar de fracciones o del principio activo purificado, distintos autores han resaltado las ventajas de este tipo de material. Se ha observado que el extracto completo contiene compuestos, especialmente flavonoides, con un efecto más sinérgico que cuando se aplica el fármaco derivado puro, destacando la inhibición del citocromo P450 humano implicado en el metabolismo de compuestos exógenos, con lo que se incrementa la vida media sérica del material administrado; la combinación de compuestos en el extracto pudiera, de esta manera, influir en un menor riesgo de desarrollo de resistencia en el parásito (Rodeiro et al. 2009). También se ha demostrado en estudios con terapia oral en modelos murinos, que la artemisinina del polvo administrado en cápsulas pasa rápidamente del sistema digestivo al torrente sanguíneo. Resultados similares fueron obtenidos en estudios con pacientes de paludismo a los que se les administró té de A. annua para tratar esta enfermedad (Rath et al., 2004; Weathers et al., 2011).
El extracto vegetal se ensayó en el crecimiento in vitro de promastigotes de L. (V) braziliensis y L. (L) mexicana, especies prevalentes en las distintas regiones endémicas de Venezuela, resaltando que en general distintos investigadores han realizado estudios con las especies L. major y L. donovani del Viejo Mundo y con L. (V) panamensis del Nuevo Mundo. Se probaron varias concentraciones del extracto. Se observó que la concentración más baja redujo en más del 30 % el número de promastigotes para las cepas en estudio, mientras que la más alta causó una reducción entre 90 y 100 %. Esto pone en evidencia un efecto inhibitorio de A. annua sobre el crecimiento y multiplicación in vitro de los promastigotes de estas especies, concordando con los resultados de otros investigadores en otras especies de Leishmania spp.
Otra prueba realizada en este estudio consistió en la obtención de promastigotes de M2903 resistentes al Glucantime para evaluar el efecto del extracto vegetal en su crecimiento. Tal resistencia se obtuvo incrementando gradualmente durante los repiques, la concentración de la droga. A este respecto, distintos investigadores han demostrado la susceptibilidad in vitro de promastigotes de Leishmania spp. a antimoniales y que dicha sensibilidad es menor a la reportada para amastigotes dentro de macrófagos en el caso del Glucantime, pero similar en el caso del Pentostam (Berman et al., 1989). Tal acción inhibitoria del Glucantime se ve afectada por la composición del medio de cultivo, reportándose en medios complejos no suplementados, mientras que en medios suplementados y muy ricos en nutrientes tiende a observarse resistencia a la droga por parte de los promastigotes; esto pudiera explicar la existencia de resultados controversiales en cuando a la sensibilidad de promastigotes al Glucantime (Moreira et al., 1995). Por su parte, Moreira y Petrillo-Peixoto (1991), evaluando el efecto del Glucantime en el crecimiento in vitro de promastigotes de Leishmania en Suramérica, reportan diferencia de susceptibilidad entre distintas cepas, observando en las más sensibles naturalmente (L. (V) braziliensis M2903 y L. (V) guyanensis M1176) la inhibición dosis-dependiente del crecimiento, en un rango de 0,23 a 23 mM; las cepas naturalmente resistentes (L. (L) amazonensis M10996 y L. (V) braziliensis LTB259), fueron inhibidas a concentraciones mucho más altas del antimonial (entre 20 mM- 70 mM). Similarmente a este estudio, Grogl et al. (1989) desarrollaron resistencia al Glucantime en promastigotes naturalmente sensibles, exponiéndolos gradualmente a concentraciones crecientes de la droga. Señalan la inestabilidad de esta resistencia en parásitos con pocos pases en presencia de la droga (tres o menos) y la observación de estabilidad después del tercer repique; en consecuencia, hacen énfasis en el riesgo de emergencia de resistencia a antimoniales en Leishmania debido a la aplicación de dosis inadecuadas de la droga durante el tratamiento de la parasitosis.
En este estudio, se trabajó con promastigotes de M2903 expuestos al antimonial durante más de 6 pases y al tratarlos con el extracto vegetal se obtuvieron resultados similares a los de promastigotes sensibles creciendo en presencia de dicho extracto, lo que pone en evidencia la posible utilidad de este vegetal en pacientes que desarrollen resistencia o tengan poca respuesta al tratamiento con el Glucantime. Al comparar el efecto de Artemisia annua en el crecimiento de los promastigotes de L. (V) braziliensis, (especie más común encontrada en Venezuela) con el del Glucantime, se observó que la acción del fármaco a la concentración utilizada fue menor que la de las dosis probadas del extracto vegetal, resaltando aún más la utilidad de la planta en el tratamiento de la Leishmaniasis.
Los resultados de este estudio preliminar indicarían la posibilidad de usar A. annua en el tratamiento de la Leishmaniasis relacionada a L. (V) braziliensis y L. (L) mexicana, destacando el efecto inhibitorio en el crecimiento del parásito y la nula toxicidad para macrófagos e, incluso, pacientes, según resultados obtenidos por otros investigadores. Ya la OMS ha señalado la utilidad de esta planta en el tratamiento de paludismo. En el caso del tratamiento de la Leishmaniasis, debido a la posibilidad del eventual desarrollo de resistencia por parte del parásito, es importante considerar la implementación de esta planta en combinación con otros compuestos, así como la realización de evaluaciones que permitan determinar la dosis más adecuada para evitar o reducir el riesgo de pérdida de susceptibilidad. También son muy importantes para este tópico aquellos estudios que permitan establecer el mecanismo de acción inhibitorio de A. annua sobre el crecimiento de Leishmania spp. A futuro, como continuación de este estudio preliminar, es de interés realizar pruebas ampliando el rango de concentraciones del extracto y las especies de Leishmania, en promastigotes, amastigotes y “amastigotes like”, así como en modelos murinos, para conocer realmente el potencial de esta planta en el tratamiento de la Leishmaniasis.