La Leishmaniasis cutánea americana (LCA) presenta distintas formas clínicas activas con diferentes grados de severidad: cutánea localizada (LCL), difusa (LCD), cutánea mucosa (LCM) e intermedia (LCI). Las células dendríticas (CDs) están involucradas en el inicio y regulación de la respuesta inmunitaria protectora frente al parásito Leishmania, por lo cual su determinación es importante para comprender la inmunopatología relacionada con esta enfermedad y el desarrollo de nuevas alternativas terapéuticas. El objetivo de este trabajo fue estandarizar la estrategia de análisis por citometría de flujo, para medir la frecuencia y grado de maduración/ activación de las CDs circulantes de pacientes con LCA y sujetos sanos. El marcaje de inmunofluorescencia directa se realizó a 22 muestras de sangre completa con anticuerpos acoplados a fluorocromos: Lin-1-FITC, HLA-DR-PerCP, CD11c-FITC, CD123-PE, CD86-APC, CD83-APC. Las CDs se distinguieron entre las HLA-DR+ Linaje-: la expresión de CD11c definió a CDs mieloides (CDsM) y CD123 a CDs plasmocitoides (CDsP). El grado de maduración y activación fue de acuerdo a CD86 y CD83, respectivamente. Las CDsM y CDsP eran mayores en los pacientes LCL comparado con control y pacientes LCI y LCD (p<0,05). La relación CDsM/CDsP en pacientes LCI (10,5) fue mayor que en controles (7,47), LCL (7,06) y LCD (6,38). Los LCL tenían mayor proporción de CDsM CD83+ que controles, LCI y LCD (p<0,05). La estrategia de análisis por citometria de flujo empleada nos permitió evaluar este grupo celular tan importante en la respuesta inmune frente a infecciones.
Palabras clave: Células dendríticas; Inmunofluorescencia; Citometría de flujo; Leishmaniasis cutánea americana.
American cutaneous Leishmaniasis (ACL) presents different active clinical forms with different degrees of severity: cutaneous (LCL), diffuse (DCL), mucocutaneous (MCL) and intermediate (ICL). Dendritic cells (DCs) are involved in the initiation and regulation of the protective immune response against the Leishmania parasite, therefore determination of DCs is important to understand the immunopathology related to this disease and the development of new therapeutic alternatives. The objective of this work was to standardize the analysis strategy by flow cytometry, to measure the frequency and degree of maturation/activation of circulating DCs from patients with ACL and healthy subjects. Direct immunofluorescence labeling was performed on 22 whole blood samples using fluorochrome-coupled antibodies: Lin-1-FITC, HLA-DR-PerCP, CD11c-FITC, CD123-PE, CD86-APC, and CD83-APC. DCs were distinguished between HLA-DR+ Lineage- cells: CD11c expression defined myeloid DCs (DCsM) and CD123 defined plasmacytoid DCs (DCsP). The degree of maturation and activation was defined according to CD86 and CD83 expression, respectively. DCsM and DCsP were higher in LCL patients versus controls, ICL and DCL patients (p <0.05). The DCsM/DCsP ratio of ICL (10.5) was higher than in controls (7.47), LCL (7.06) and DCL (6.38). LCL had a higher proportion of DCsM CD83+ than controls, ICL and DCL (p <0.05). Our flow cytometric analysis strategy allowed evaluating this important cell group in the immune response against infections.
Key words: Dendritic cells; Immunofluorescence; Flow cytometry; American cutaneous Leishmaniasis.
La Leishmaniasis es una enfermedad inflamatoria crónica que comprende un amplio espectro de manifestaciones clínicas; desde úlceras cutáneas hasta infecciones viscerales fatales, considerada por la Organización Mundial de la Salud como una de las enfermedades parasitarias más importantes con aproximadamente 350 millones de individuos en riesgo de contraerla, siendo la incidencia y prevalencia anual estimada de 600.000 y 12 millones de pacientes, respectivamente (Ashford et al., 1992; Desjeux, 2004). En las Américas se reportaron 989.096 casos de Leishmaniasis Cutánea entre 2001 y 2018 con un promedio anual de 54.950 casos (Organización panamericana de la salud, OPS, 2019).
La leishmaniasis cutánea Americana (LCA) presenta distintas formas clínicas activas con diferentes grados de severidad, conocidas como Leishmaniasis cutánea localizada (LCL) que es la forma menos severa, usualmente limitada a una simple o pocas ulceras en la piel de individuos inmuno-respondedores; Leishmaniasis cutánea difusa (LCD) es la forma más severa de la enfermedad desarrollada por individuos susceptibles, en los cuales las lesiones son múltiples nódulos no ulcerados y placas; Leishmaniasis mucocutánea (LCM) y Leishmaniasis cutánea intermedia (LCI) que son formas atípicas de la Leishmaniasis que se localizan en el centro del espectro (Convit et al., 1993).
La inmunopatogénesis de la Leishmaniasis depende de una compleja interacción entre el vector, el parásito y el hospedador (Scott y Novais, 2016). Dentro de los componentes principales de la respuesta inmune contra el parasito figuran las células dendríticas (CDs) que son una familia de células presentadoras de antígenos (CPA) “profesionales”, especializadas en la captura, procesamiento y presentación de antígenos a los linfocitos T (Hart, 1997; Steinman y Hemmi, 2006). El papel de las CDs en la Leishmaniasis ha constituido un punto de fuertes estudios que en conjunto señalan una participación crucial en el inicio y regulación de la respuesta inmunitaria protectora (Flohé et al., 1998; Gorak et al., 1998; Henri et al., 2002; Aguilar et al., 2002; Prina et al., 2004; Tsagoziz et al., 2004; Soong, 2008; Kautz-Neu et al., 2012; Feijó et al., 2016, Von Stebut y Tenzer, 2018; Dietze-Schwonberg et al., 2018; Tiburcio et al., 2019).
En los últimos años ha cambiado la visión de las células dendríticas como una población homogénea. Diversos estudios han demostrado que existe una variabilidad en la expresión de moléculas estructurales y de activación que colectivamente las diferencia de otros leucocitos y entre ellas, lo cual ha permitido su clasificación según su estado de diferenciación y sus funciones (Henri et al., 2001; Kadowaki et al., 2001; Nagai, 2017).
En su estado inmaduro las CDs son capaces de capturar y procesar antígenos en todos los tejidos periféricos no linfoides, expresan ciertos receptores de quimiocinas (por ejemplo, CCR6), receptores lectinas tipo C I y II (BDCA-2,-3,-4; CD205) miembros de la superfamilia de las inmunoglobulinas, receptores Fc, receptor de manosa (MR), receptores para proteínas de choque térmico (hsp) y receptores tipo Toll (TLR-2, -3). La expresión de muchos de estos receptores disminuye durante la maduración de la CD, enfatizando su función específica en la captura de antígenos (Kadowaki et al., 2001; Nagai, 2017).
Después del contacto con señales de peligro (patógenos, citocinas proinflamatorias o células necróticas) las CDs migran a las áreas de linfocitos T de órganos linfoides, donde presentan antígenos a linfocitos T vírgenes y modulan su respuesta. Simultáneamente experimentan un proceso de maduración y modulación de la expresión de quimiocinas y receptores de quimiocinas. Además, este proceso induce el aumento de la producción de una variedad de citocinas, y la expresión de moléculas de coestimulación y adhesión, que promueven colectivamente la interacción CDlinfocito T (Nagai, 2017; Kim y Kim, 2019).
En humanos, se han descrito dos subtipos de CDs en sangre periférica, CDs mieloides (MDCs) y plasmocitoides (PDCs). Estas células difieren ampliamente en muchos aspectos; expresan diferentes patrones de receptores que reconocen patógenos (PRR) y acorde a éstos responden a diferentes antígenos microbianos, producen diferentes receptores de citocinas y como resultado responden a diferentes citocinas, expresan diferentes citocinas en respuesta al mismo estímulo y finalmente difieren ampliamente en la capacidad de migrar frente a estímulos antigénicos, aunque el patrón de expresión de receptores para quimiocinas es similar (Jarrossay et al., 2001; Kadowaki et al., 2001; Collin y Bigley, 2018). Estas diferencias inscriben los diferentes roles de las MDCs y PDCs en la inducción y regulación de la respuesta inmunitaria.
En virtud de la plasticidad fenotípica de las CDs, de su estado de activación y su localización en tejidos periféricos, constituyen las principales células que dirigen la respuesta inmunitaria frente a patógenos intracelulares cuya puerta de entrada es la piel. Por otra parte, algunos estudios han demostrado que son esencialmente flexibles a las señales de peligro y por ende, pueden promover diferentes fenotipos de linfocitos T (Th1, Th2 o Treg) (Kushwah y Hu, 2011), por lo cual determinar la participación de las diferentes CDs durante la infección por Leishmania, es de gran importancia para comprender la inmunopatología relacionada con esta enfermedad y el desarrollo de nuevas alternativas terapéuticas.
Los estudios de CDs han sido obstaculizados por su baja frecuencia en la sangre y los tejidos, por lo cual, la mayoría de los conocimientos sobre las CDs se han obtenido principalmente de estudios de CDs enriquecidas por centrifugación en gradientes de densidad, cultivo y/o selección negativa (Vremec et al., 1997; Anjuère et al., 1999). Estos procedimientos utilizan las propiedades densidad y adhesión de las CDs, su crecimiento selectivo en ciertas combinaciones de citocinas, o su falta de expresión de marcadores de linaje de linfocitos, monocitos y granulocitos (Lin) (Vremec et al., 1997). Estos métodos, sin embargo, proporcionan bajo rendimiento y pureza de las CDs, y consumen mucho tiempo. Además, la manipulación puede alterar las células funcionalmente y no permitir la cuantificación de las CDs. Sin embargo, diversos trabajos mostraron la existencia de algunos receptores en la membrana celular de CDs, que ha permitido la caracterización de células no manipuladas (Dzionek et al., 2000, 2001; Patel y Metcalf, 2016).
En la práctica, existen diversas metodologías para el estudio celular. Una de estas, es la Citometría de Flujo, la cual está basada en el concepto general de la unión específica Antígeno-Anticuerpo. El Anticuerpo usado se encuentra conjugado a un fluorocromo específico, que al ser excitado por la acción de un láser, emite una señal de luz en determinado espectro. Esta señal emitida por el fluorocromo es captada por detectores específicos y los datos obtenidos se almacenan en la memoria de un computador y desde allí son pasados a archivos binarios que posteriormente pueden ser analizados (Oughton et al., 2005; Pockley et al., 2015). Existen diversas aplicaciones de la citometría de flujo en el área clínica y de investigación, una de las más comunes es la caracterización de subpoblaciones celulares del sistema inmune.
Debido a las características fenotípicas de las CDs que las distinguen de otras células y entre ellas, y la existencia de anticuerpos específicos contra los marcadores de CDs recientemente identificados, el sistema que emplea la citometría de flujo permitirá la detección simultánea, cuantificación, y el aislamiento de los distintos subtipos de CDs presentes en sangre periférica. El procedimiento de citometría de flujo que se basa en la detección tres o cuatro señales de fluorescencia, es rápido, y permite el uso de pequeños volúmenes de muestra. Esta metodología proporcionaría una herramienta que facilitará futuros estudios para dilucidar el papel de las CDs en la regulación de la inmunidad durante condiciones fisiológicas y patológicas.
El presente trabajo tuvo como objetivo estandarizar la estrategia de análisis por citometría de flujo para determinar la frecuencia y grado de maduración/activación de las CDs circulantes de pacientes con LCA.
Muestras: Un total de 24 muestras de sangre completa (5 mL) fueron tomadas por venopunción en tubos con anticoagulante EDTA a pacientes con edades comprendidas entre 20 y 55 años, y con diferentes formas clínicas de Leishmaniasis cutánea: LCL (n=10), LCI (n=5) y LCD (n=1) que acudieron a la consulta de Leishmaniasis y Epidemiología del Instituto de Biomedicina (diagnosticados de acuerdo a los criterios clínicos, epidemiológicos e histopatológicos establecidos por Convit et al. (1974), posterior a declaración y firma del consentimiento informado. También se incluyeron 6 controles sanos para comparar la medición de CDs en sangre en condiciones fisiológicas, con los sujetos que presentan LCA.
Selección de anticuerpos y fluorocromos: En la actualidad la identificación de CDs en sangre está basada en ciertos criterios de inmuno-fenotipaje. En este trabajo se seleccionó la presencia de HLA-DR, pero como esta molécula es expresada también en otros leucocitos, se escogió para separar las CDs, la ausencia de un panel de antígenos linaje específico de leucocitos (CD3, CD14, CD16, CD19, CD20 y CD56). Así, las diferentes subpoblaciones de CDs se distinguieron entre las HLA-DR+ Linaje-, basadas en la expresión de CD11c sobre CDs mieloides y CD123 sobre CDs plasmocitoides. Para esta aproximación de medición de CDs en sangre periférica, se emplearon entonces 4 anticuerpos acoplados a distintos fluorocromos seleccionados de acuerdo a lo disponible en el mercado y a las combinaciones de anticuerpos necesarias para la definición celular. La detección del grado de maduración y activación de los subtipos de CDs se hizo de acuerdo a la expresión de los receptores de membrana CD86 y CD83. Como se muestra a continuación los fluorocromos incluidos fueron PerCP, PE, FITC y APC.
Anticuerpos acoplados a fluorocromos empleados: Anti-Lin-1 conjugado con FITC (BD Pharmigen), Anti-HLA-DR conjugado con PerCP (BD Pharmigen), Anti-CD11c conjugado con FITC (AbD serotec), Anti-CD123 humano acoplado a PE (BD Pharmigen), Anti-CD86 humano conjugado con APC (BD Pharmigen), Anti-CD83 humano conjugado con APC (BD Pharmigen).
Caracterización de moléculas de superficie de la membrana celular para determinación de CDs: El método de marcaje de inmunofluorescencia directa fue el empleado para la enumeración y caracterización de las CDs circulantes. El protocolo consistió en: identificar cinco tubos (Tubo 1: Control negativo (sin marcaje), Tubo 2: Lin-1 FITC / HLA-DR PerCP, Tubo 3: HLA-DR PerCP / CD123 PE/ CD11c FITC, Tubo 4: HLA-DR PerCP / CD123 PE / CD83 APC, Tubo 5: HLA¬DR PerCP / CD11c FITC / CD86 APC), luego se les añadió a cada tubo el anticuerpo monoclonal correspondiente (5 μL de anti-Lin1 y anti-HLA-DR PerCP; 3 μL de anti-CD123 PE, anti-CD11c FITC, anti¬CD83/CD86 APC). Posteriormente, se colocaron 200 μL de sangre periférica EDTA a todos los tubos, se mezclaron suavemente y se incubaron en oscuridad por 30 min a temperatura ambiente (TA). Se agregaron 500 μL de buffer de lisis a todos los tubos (para eliminar los glóbulos rojos). Se mezcló suavemente con un vortex e incubó 15 min a TA en oscuridad. Se volvió a mezclar y se incubó 15 min. en las mismas condiciones. El sobrenadante se descartó en su totalidad y se lavó con 500 μL de buffer fosfato salino (PBS). El botón celular se mezcló bien con vortex hasta obtener una suspensión homogénea. Finalmente, se añadieron 300 μL de buffer salino con paraformaldehído al 1% (PAF 1%) con el fin de mantener fijadas las células hasta la posterior lectura de la fluorescencia en el citómetro de flujo (BD FACSCanto®). Los tubos fueron almacenados en oscuridad a 4ºC bien tapados.
La cantidad de anticuerpo a emplear en el marcaje, se determinó haciendo titulación del mismo según las indicaciones del fabricante (10μL, 5μL, 3μL), escogiéndose el volumen del anticuerpo mínimo que permitiera una separación de las fluorescencias al realizar las combinaciones de colores.
En virtud de la baja proporción de CDs en sangre comparado con el resto de los leucocitos, escogimos un volumen de 200 μL de sangre y no 50-100 μL, que es lo usualmente empleado para inmunofenotipaje, para asegurar estudiar una cantidad representativa de CDs.
Adquisición y análisis de los datos. En primer lugar se realizó una calibración del equipo empleando perlas Calibrite (BD BioSciences) para ajustar los voltajes de los fotomultiplicadores (PMT), compensación de fluorescencia y chequear la sensibilidad del instrumento. Luego, se adquirieron las muestras preparadas para leer la fluorescencia en el citómetro de flujo empleando el software BD FACS-Diva con un umbral (threshold) sobre la dispersión frontal (FSC) que excluya los detritos celulares. Debido a la baja frecuencia de las CDs en sangre periférica, la adquisición fue de 100.000 eventos para aumentar la probabilidad de contar más CDs. Para obtener los resultados de la proporción de células que expresan las moléculas evaluadas al igual que la densidad de expresión de las mismas, se analizaron los datos adquiridos con el software BD FACS-Diva diseñando estrategias para la escogencia de las ventanas que representan las diferentes poblaciones celulares. Estas estrategias se describen en la sección de resultados.
I.- Estrategias para el análisis de los datos adquiridos en el Citómetro de flujo para la valoración de CDs en sangre periférica. Para evaluar la frecuencia y grado de maduración de las CDs en sangre periférica de los individuos sanos y pacientes con Leishmaniasis Cutánea Americana empleando citometría de flujo, se siguieron las siguientes estrategias de análisis:
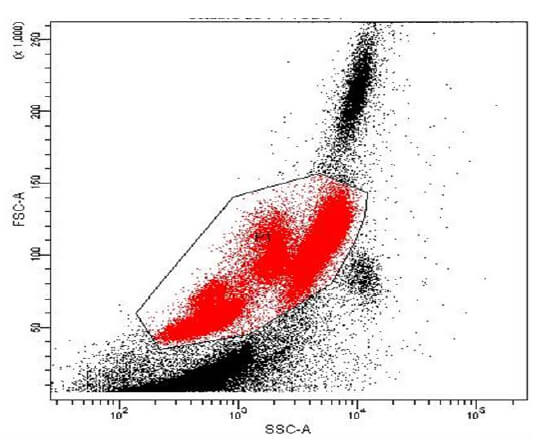
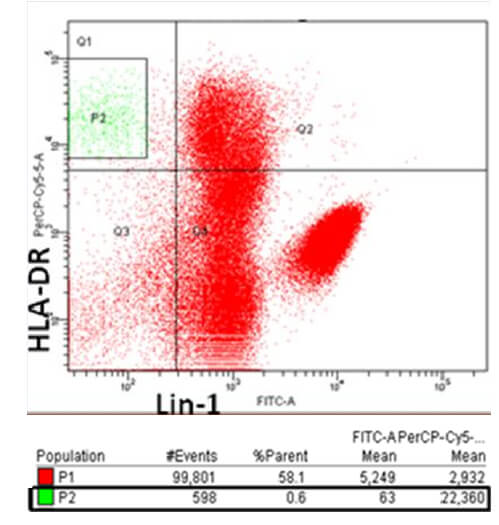
Análisis 1: se presentan los valores porcentuales de las CDs en la población P1 que incluye los leucocitos, que como se observa en la Figura 3A es el 61,2% del total de los eventos adquiridos. Con el tubo 3 (HLA-DR PerCP/CD123 PE/CD11c FITC), se crearon los diagramas de fluorescencia anti-HLA-DR/CD123 (Figura 3A) y anti-HLA-DR/CD11c (Figura 3B) de la P1, obteniéndose los subtipos de CDs. Por no contar con el recurso para la adquisición del anti-CD11c conjugado con otro fluorocromo diferente a FITC, no se pudo realizar la separación de las CDs por ausencia de los marcadores de linaje, por lo cual se acudió a un segundo análisis extrapolando la P2.
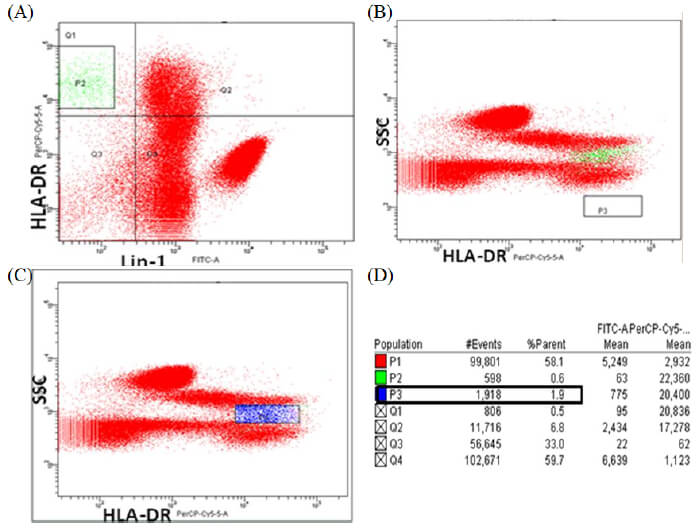
Análisis 2: con este análisis se obtuvo la proporción de los subtipos de CDs pero teniendo como población total la P2 extrapolada en un citograma de fluorescencia que solo contempla el marcaje HLA-DR. Para ello, se creó un citograma SSC (granularidad) vs HLA-DR de la P1 conteniendo la población 2 HLA-DR+ Lin- (P2- color verde) del citograma de fluorescencia anti-HLA-DR/Lin-1 (Figura 4A), con el fin visualizar la P2 y enmarcarla para crear una tercera población que designamos como “enriquecida de CDs” (P3- color azul) (Figura 4B, 4C).
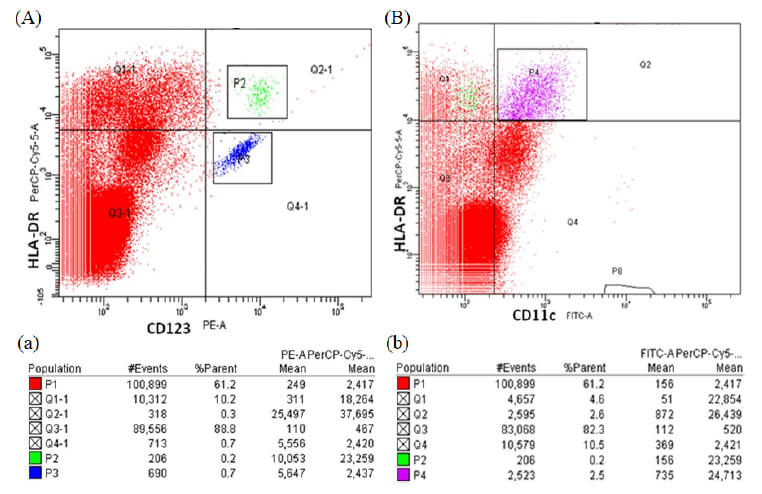
De la población enriquecida (CDs HLA-DR+ Lin-) se realizaron citogramas de fluorescencia CD11c vs CD123 para obtener los subtipos de CDs (con los datos adquiridos del tubo 3) y citogramas CD123/CD83 (tubo 4) y CD11c/CD86 (tubo 5) para evaluar el grado de maduración (Figura 5A y 5B).
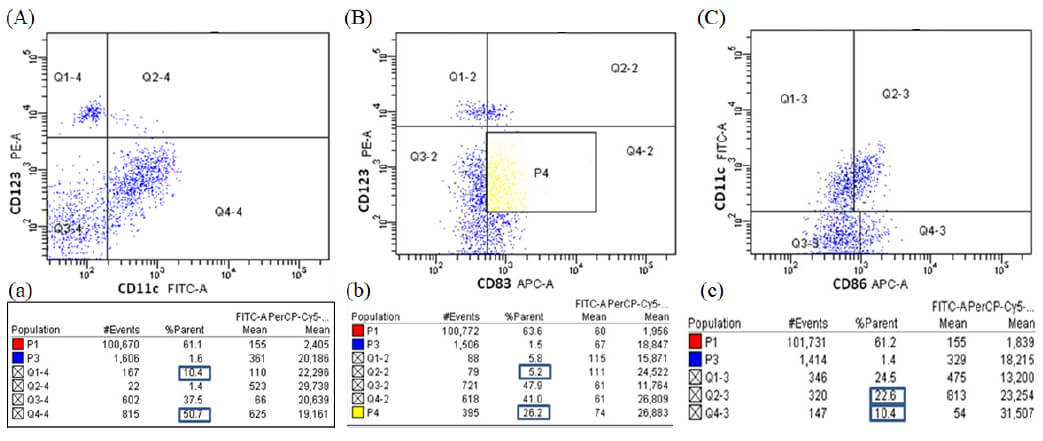
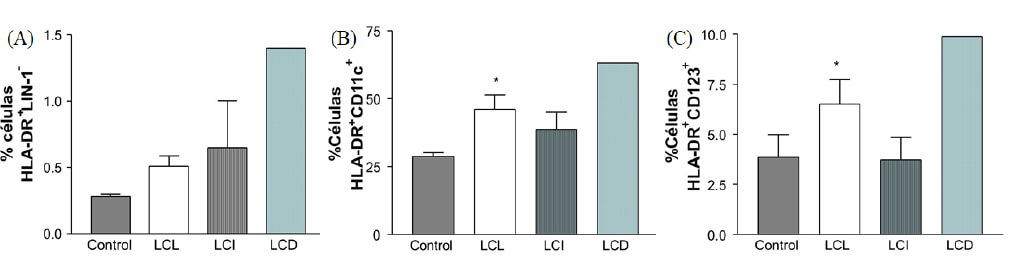
II.- Células Dendríticas en sangre periférica de sujetos sanos y pacientes con Leishmaniasis cutánea Americana. Siguiendo el análisis 2 de los datos obtenidos por el citómetro de flujo, en el figura 6 se muestra la proporción de CDs totales, CDsP y CDsM en los pacientes con LCA y controles. No se evidenciaron diferencias estadísticamente significativas en la proporción de CDs totales al comparar grupo control con los pacientes, mientras que las CDsM y CDsP eran mayores en los pacientes LCL cuando se comparó con el grupo control y los pacientes LCI y LCD (p<0,05). La relación CDsM/CDsP del grupo de pacientes LCI (10,5) fue más alta que los controles (7,47), LCL (7,06) y LCD (6,38).
La figura 7 señala la proporción de Células Dendríticas maduras (CD86+) y activadas (CD83+) en sangre periférica de controles y pacientes con Leishmaniasis Cutánea Americana. En los pacientes con LCL encontramos una mayor proporción de CDsM activadas CD83+ (p<0,05) al comparar con controles, LCI y LCD.
El ensayo se diseñó para detectar las dos subpoblaciones de CDs presentes en sangre periférica: CD123+ (Anti-IL-3Rα+) y CD11c+, y el grado de maduración y activación que ambos grupos presentan en el momento de la evaluación de los individuos en condiciones fisiológicas o patológicas.
Como fue mencionado anteriormente, estos subtipos de CDs han sido discriminados a través de los receptores de membrana CD11c y el CD123 (Patel et al., 2016), sin embargo, los mismos están expresados en otras células, por lo cual, se empleó una combinación de varios marcadores que incluyeron HLA-DR y Lin-1, aprovechando que las CDs expresan altos niveles de HLA-DR y bajos niveles de los marcadores de linaje de los monocitos, linfocitos y células NK. El Lin-1 utilizado en este ensayo es un coctel de marcadores de linaje que contiene CD3, CD14, CD16, CD19, CD20 y CD56, conjugados con un solo fluorocromo, lo cual permitió la discriminación entre las otras células mononucleares y las CDs previo a la selección de las CD123+ y CD11c+, en un solo tubo y con la misma cantidad de sangre. Con respecto a los leucocitos polimorfonucleares, el análisis permite la identificación de granulocitos basófilos puesto que son linaje negativos y expresan niveles similares de CD123 como las CDs plasmocitoides, pero pudo ser discriminado por la falta de expresión de HLA-DR (Willmann, 2003).
Una desventaja de nuestro sistema de marcaje para determinar la proporción de CDs totales y los subtipos, fue que los anticuerpos Lin-1 y CD11c estaban acoplados al mismo fluorocromo FITC, por lo cual, no se pudo realizar el marcaje directo cuatro colores HLA-DR / Lin-1/ CD123/ CD11c que nos garantizaría la escogencia de una población de CDs completamente exenta de otros leucocitos. Por otra parte, con el avance de los citómetros de flujo y diseños de análisis actualmente se pueden realizar extrapolaciones de regiones o poblaciones en el análisis (Cossarizza et al., 2017), esto permite ofrecer un discernimiento confiable a través de la selección de una población enriquecida de CDs como fue designada en este estudio, que sería una ventaja para otros centros donde no se puedan adquirir los anticuerpos necesarios.
Las diferencias observadas en los análisis 1 y 2 en cuanto a la proporción de CDsP y CDsM se debe a que en el primer análisis el cálculo de las poblaciones de las CDs circulantes se obtuvo a partir de los leucocitos totales que designa el valor real de estas células en sangre periférica, por eso se obtienen valores porcentuales muy bajos. Mientras que en el análisis 2, el cálculo se realizó con respecto a las CDs definidas por la expresión de receptores específicos, por lo cual, se muestra la proporción de CDsP y CDsM que están en la población enriquecida de CDs.
Otro punto de interés fue determinar el grado de maduración y activación de las CDs en la sangre de los individuos evaluados. Diversos autores han demostrado la expresión de varias glicoproteínas de membrana en las CDs que pasan de un estado inmaduro a uno maduro y/o de activación, como son las moléculas de co-estimulación (Zhou et al., 1995; Hart et al., 1997). La literatura consultada permitió seleccionar el CD86 y el CD83 para la evaluación de estos aspectos.
Una ventaja de la estrategia de análisis 2 fue que se puede obtener la información de maduración/activación (dos marcadores) de los subtipos de CDs, empleando solo 2 tubos: en el Tubo 4 colocamos CD123 y CD83, pero como los diagramas de fluorescencias se hicieron contemplando la P3 (enriquecida de CDs) el análisis arrojo la proporción de CDs CD123+ CD83+ (plasmocitoides) y CDs CD123-CD83+ que representa el otro subtipo de CDs (mieloides). En el tubo 5 se caracterizaron las células con CD11c y CD86, obteniendo la proporción de CDs CD11c+ CD86+ (mieloides) y CDs CD11c- CD86+ (plasmocitoides).
De los datos obtenidos por citometría de flujo se aprecia que existe similar proporción de CDs totales en pacientes con LCA e individuos sanos. Los pacientes con LCA (LCD>LCL>LCI) tienen más CDsM que los controles. La mayor relación de CDsM/CDsP observada en los LCI con respecto a controles y LCL, pudiera indicar una deficiencia en CDsM o un aumento de las CDsP en este grupo de pacientes.
Los resultados muestran un mayor número de CDsM activadas CD83+ en LCL. El CD83 tiene un papel modulador en la presentación antigénica y generación de linfocitos T CD4+ (Feilo et al., 2016), por lo que su expresión en CDs de pacientes LCL pudiera asociarse con la resolución de la enfermedad.
La acumulación de CDsP ha sido demostrada en la respuesta inflamatoria de varias enfermedades (Galicia et al., 2014; Swiecki y Colonna, 2015). Los pacientes LCI expresan una mayor densidad del factor de coestimulacón CD86 en CDsP con respecto a pacientes LCL, sugiriendo su participación en la respuesta inflamatoria exacerbada característica de estos pacientes LCI. Estos resultados conminan a evaluar más detalladamente el papel de las CDsP en la inmunopatología asociada a LCI y LCD.
En líneas generales, se logró estandarizar el inmunofenotipaje de CDs en sangre periférica, lo cual representa una excelente herramienta para la evaluación de este grupo celular tan importante en la respuesta inmune que se suscita frente a las infecciones o señales de peligro, al igual que en la inmunotolerancia en ciertas condiciones. Con esta técnica, futuros estudios estarían encaminados a la evaluación de los aspectos funcionales de estos subtipos de CDs en la LCA y en otras enfermedades.
Trabajo financiado por el Proyecto Grupal CDCHUCV. PG-09-8736-2013/1.