El polen de las gramíneas figura como una de las causas más importante de polinosis a nivel mundial. En Venezuela son pocos los reportes de reacciones alérgicas a gramíneas. No obstante, entre los meses de noviembre a marzo se registra un aumento en la incidencia de las patologías alérgicas en varias ciudades del país, particularmente en Caracas. Las investigaciones sobre la sensibilización a esta gramínea han sido limitadas y hasta la fecha no existe en el mercado latinoamericano ningún extracto comercial de potencia estandarizada de esta gramínea. Se preparó un extracto de procedencia local siguiendo estándares internacionales, y se evaluó la reactividad alérgica a Mellinis minutiflora en pacientes alérgicos Venezolanos. Se determinó la toxicidad aguda y crónica en un modelo murino y se evaluaron 608 pacientes de la Consulta de Alergia del Instituto de Biomedicina. No hubo toxicidad aguda ni crónica en el modelo murino. Mellinis minutiflora presento una positividad de 22,6 % en los pacientes evaluados. Se reporta una actividad biológica de 48,20UB/ml. Existió un porcentaje importante de positividad en prueba cutánea al extracto de Mellinis minutiflora (Capim melao), mayor que a un extracto comercial de otras gramíneas que no incluyen a Capin melao (pólenes IV). Un importante número de pacientes reaccionan exclusivamente a Capin melao en pruebas cutáneas. Nuestros resultados sugieren la importancia de incorporar de rutina a la batería de alérgenos que se usa para la evaluación de pacientes alérgicos, a extractos localmente producidos como el de Mellinis minutifloraa que podría ser el responsable de un porcentaje importante de cuadros alérgicos en diferentes poblaciones.
Palabras clave: Melinis minutiflora; alergia; pruebas cutáneas; gramíneas.
Grass pollen is one of the most important causes of pollinosis worldwide. In Venezuela, there are few reports of allergic reactions to grasses. However, between the months of November to March there is an increase in the incidence of allergic pathologies in several cities in the country, particularly in Caracas. Research on sensitization to this grass has been limited and to date there is no commercial extract of standardized potency of this grass in the Latin American market. An extract of local origin was prepared following international standards, and allergic reactivity to Melinis minutiflora (Capim melao) was evaluated in Venezuelan allergic patients. Acute and chronic toxicity were determined in a murine model and 608 patients from the Allergy Consultation of the Institute of Biomedicine were evaluated. There was no acute or chronic toxicity in the murine model. Melinis minutiflora presented a positivity of 22.6% in the evaluated patients. A biological activity of 48.20UB / ml is reported. There was a significant percentage of skin test positivity to the extract of Melinis minutiflora, higher than to a commercial extract of other grasses that do not include Capin melao (pollens IV). A significant number of patients react exclusively to Capin melao in skin prick tests. Our results suggest the importance of routinely incorporating locally produced extracts such as Melinis minutiflora into the allergen battery used for the evaluation of allergic patients, which could be responsible for a significant percentage of allergic conditions in different populations
Key words: Melinis minutiflora; allergy; skin prick test; grass.
Las gramíneas han sido objeto de extensos estudios en los últimos años y debido a la gran alergenicidad de sus pólenes y a su extensa distribución vegetal, han demostrado ser una de las causas más importante de polinosis a nivel mundial (Subiza, 2003). Las especies Phleum pratense, Lolium perenne, Cynodon dactylon, Bromus catharticus, Dactylis glomerata y Festuca pratensis, se encuentran entre las principales gramíneas causales de alergia en los contenientes americanos y europeo (Anderson, 2003). En Venezuela, la familia de las Poaceae se encuentra representada por cerca de 111 géneros y 549 especies de gramíneas (Huber et al., 1998). Melinis minutiflora (Capim melao), es una gramínea nativa del África, introducida primero a Brasil y posteriormente a Venezuela (Mondolfi, 1957). Pertenece a la Familia: Poaceae, Subfamilia: Panicoideae, Tribu: Paniceae, Género: Melinis, Especie: Melinis minutiflora. Nombre: Mellinis minutiflora P Beauv. (Baruch, 1985). Esta gramínea florece entre noviembre a marzo en diversas partes de Venezuela (Hurtado y Riegler-Goihman, 1984; Perdomo-Ponce et al., 1991).
Se encuentra distribuida en varias zonas a nivel mundial. No obstante, las manifestaciones alérgicas a esta gramínea no han sido muy estudiadas. El Dr Benaim Pinto en 1960 reporta un 17% de positividad en pruebas alérgicas cutáneas frente al extracto de esta gramínea, y una prevalencia del 40% en un grupo pequeño de pacientes con alergia respiratoria (Pinto, 1960). Posteriormente, la Dra Perdomo de Ponce y col, (1991) elaboraron el primer calendario polínico de la ciudad de Caracas y confirman la presencia y los períodos de floración de Melinis minutiflora (Capim melao), como la principal gramínea en el valle caraqueño, con picos de floración entre octubre y marzo (Perdomo de Ponce et al., 1991). Nuestro grupo en el 2009, realizó el primer estudio preliminar de evaluación de la reactividad alérgica frente a Mellinis minutiflora en niños alérgicos. No obstante, hasta la fecha no se ha incorporado este antígeno en la rutina de evaluación, que incluye la realización de pruebas cutáneas y la detección de IgE específica, del paciente alérgico venezolano ni de Latinoamérica.
Tampoco ha sido determinado su papel en la exacerbación de diferentes enfermedades alérgicas durante su floración. En este estudio se preparó un extracto local, estandarizado de polen de Melinis minutiflora, se determinó su toxicidad aguda y crónica en modelo murino, y se evaluó su actividad biológica así como la reactividad cutánea en 608 pacientes alérgicos venezolanos y se estableció la comparación de la reactividad cutánea con un extracto de gramíneas que se usa de forma comercial, pero que no incluye a Capin melao en su composición.
La gramínea se recogió durante el periodo de máxima floración, octubre a enero (2008-2012) en lugares distantes de caminos y carreteras, de acuerdo a las sugerencias descritas previamente (Pinto, 1960). Cada tallo fue desprovisto de sus hojas y colocado en envases de agua, hasta que se desprendieron los granos de polen que se colocaron en un desecador con gel de sílica para evitar la hidratación del polen. Se purificó el polen, eliminando los desechos más gruesos como pelos y restos de antenas, pasándolo a través de un tamiz de acero inoxidable con poros no mayores a 40 micras, y se clasificó como “puro”, cuando no contenía más de 0,5-1% de partículas extrañas. Internacionalmente, se acepta un nivel de contaminación del polen del 1%. (Codina et al., 2016; Nazila et al., 2018). Los gránulos purificados se conservaron permanentemente en desecador.
La extracción proteica se realizó como se ha descrito previamente (Puccio et al., 2004), agregando 200ml de la solución extractora de proteínas de Bicarbonato de Amonio 0.05M pH=8.0 por 10grs de Melinis minutiflora (Capim melao) en agitación por 48 horas a 4 °C. Posteriormente, se filtró por 0.45 y 0.22 um y se dializó por 48 horas con solución de cloruro de sodio (NaCl) al 0.85%. Se liofilizó en los envases correspondientes utilizando un liofilizador comercial FreeZone 4.5 Liter Freeze Dry Systems (Labconco) según el protocolo descrito por la casa comercial. Al producto liofilizado se le realizó extracción lipídica mediante precipitación con metanol/cloroformo (Wessel et al., 1989). Finalmente el pellet de proteínas fue resuspendido en buffer fosfato salino (PBS) y almacenado a -20ºC hasta el momento de su uso.
Se determinó la concentración de proteínas con el método de Bradford, y luego se realizó la electroforesis en gel de poliacrilamida Se dializó y filtró en condiciones de esterilidad y luego se determinó la toxicidad aguda y crónica del extracto al ser inyectado en ratones de experimentación para posteriormente preparar el extracto para la aplicación en pruebas de piel en el grupo de estudio de acuerdo a estándares internacionales de preparación de extractos alergenicos.
Los ratones fueron suministrados y mantenidos por el Bioterio del Instituto de Biomedicina y se siguieron las normas éticas de experimentación en animales. Se evaluó la toxicidad aguda del extracto Capim melao a 10.000 PNU/mL (200 UI/mL), ya que ladosis recomendada de preparaciones alergénicas para diagnóstico para animales de experimentación deberá situarse en el rango mayor de la aceptada para humanos, en 10 ratones de la cepa NMRI y 5 controles, a los cuales se les aplicó solo la solución diluyente del extracto en condiciones de esterilidad. Se controló el peso de los animales al inicio y fin del experimento como parámetro demostrativo de toxicidad, considerándolo positivo si la pérdida de peso excediere al 10% del peso vivo inicial del animal.
Se midió la extravasación de plasma (hemoconcentración) provocada en la cepa de ratones NMRI por la inyección por vía intraperitoneal de 0.2 mL del extracto (0.6 mg/mL), modificación de protocolo de Iff y Vaz, (1966). Determinando el porcentaje de hemoconcentración en muestras de 10 ul de sangre extraída de la cola antes y 10, 20 minutos después de la inyección del extracto. Para esto, las muestras de sangre fueron diluidas en 5 ml de una solución de Na2CO3 al 0.1 % y se midió la densidad óptica a 541 nm. Al grupo control se le inyectó solución salina 0.2 mL. El porcentaje de hemoconcentración se determinó al evaluar la DO antes y después de la inyección del extracto alergenico.
Se inyectó vía intraperitoneal 0.2 mL del extracto (0.6 mg/mL). Se observaron los animales por un período de 7 días y se controló el peso corporal al inicio y fin del ensayo. Al concluir el experimento se sacrificaron todos los animales para estudios anatomopatológicos macroscópico e histológicos en el bazo, pulmón é hígado. Se fijaron los órganos en 10 % formol y luego se prepararon cortes histológicos que se tiñeron con hematoxilina-eosina para examinarlos al microscopio.
Posterior al control microbiológico y micológico, el extracto se filtró por 0,22 μm (Millipore) en condiciones de esterilidad y se utilizó a 0.109 mg/mL en solución diluyente (50% solución fisiológica fenolada al 0,04% y 50% de glicerina).
Se determinó la actividad biológica en un grupo de 30 pacientes que asistieron para su control a la Consulta de alergia del Instituto de Biomedicina. Previo Firma del Consentimiento informado para pacientes. Se calculo la potencia alergénica al calcular que una dilución de un extracto tiene una potencia de 100UB/mL cuando, al realizar una prueba por punción en 30 sujetos clínicamente sensibles, se produce un promedio de pápula de 8,6 mm. Basándonos en que: una dilución de un extracto tiene una potencia de 100 UB/mL cuando, al realizar una prueba por punción en 30 sujetos clínicamente sensibles, se produce una media geométrica de pápula de 75 mm2 (promedio de pápula de 8,6 mm), se calculó la actividad biológica.
Se realizó un estudio descriptivo, prospectivo de corte transversal en un grupo no seleccionado de pacientes alérgicos que asistieron para su control a la consulta de alergia del Instituto de Biomedicina (2008-2014). Este estudio fue previamente aprobado por el comité de bioética del Instituto de Biomedicina (2008). Teniendo en cuenta que la población adulta alcanza la cifra de 22500000, con una prevalencia estimada de alergia de 30%, considerando un error estimado de 5% y un nivel de confianza del 95% se necesitaría evaluar una población de 325 individuos. Se incluyó un grupo de 608 pacientes previa firma del consentimiento informado. Se evaluó la reactividad alérgica en prueba cutánea, frente a algunos alergenos comunes usados de forma rutinaria, incluidos ácaros, Periplaneta americana, Blatella germanica y un extracto comercial de una mezcla de pólenes de gramíneas (ALK-Abelló) que no contienen a Melinis minutiflora (Capim melao) y que contiene las gramíneas Dactylis, Festuca, Lolium y Phleum (ALK), así como el extracto de Melinis minutiflora localmente producido.
Se obtuvo un total de 26,0 gramos de polen de Capin melao, con un rendimiento de 38,2%; y una concentración de proteínas de 2,30 mg/mL. Los controles microbiológicos y micológicos del extracto no evidenciaron contaminación del mismo. La electroforésis evidencio bandas de pesos moleculares aproximados: 166 kDa, 115 kDa, 85 kDa, 50 kDa, 36 kDa, 27 kDa y 19 kDa.
En los ratones inyectados con el extracto y en el grupo control, los valores del porcentaje de variación de la hemoconcentración pre y post inyección del extracto indicaron que no hubo toxicidad aguda, y 24 horas después de ser inyectados los ratones, estos no presentaron ningún tipo de alteración en los porcentajes de hemoconcentración.
Los estudios de toxicidad crónica demostraron que no hubo variación en el peso de los ratones ni cambios histológicos en los órganos evaluados después de la inyección del extracto al compararlos con el grupo control.
En el grupo de 30 pacientes, el extracto de Melinis minutiflora (Capim melao) tuvo una actividad biológica de 48,20 UB/ml. Los porcentajes de positividad en las pruebas cutáneas en los 608 pacientes de la Consulta Externa de Alergia del Instituto de Biomedicina, fueron: D. pterosnyssinus 60%, D. farinae 56,41%, Blomia tropicalis 60,89%, Anisakis simplex 17,31%, Blatella germanica 44,23%, Periplaneta americana 40%.
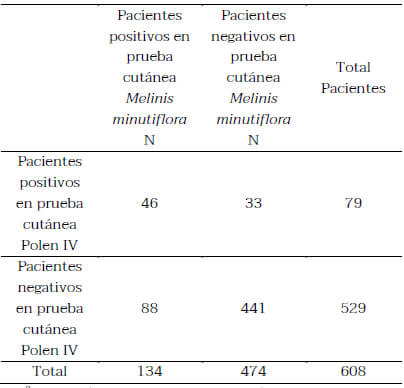
La prevalencia de sensibilización a los pólenes comerciales Polen IV (Dactylis, Festuca, Lolium y Phleum) fue de 12,99%, y el porcentaje de positividad obtenido frente al polen de Melinis minutiflora (Capim melao) fue del 22,03%.
El promedio del tamaño de las pápulas de los pacientes a la mezcla de pólenes IV fue de 3,2mm, mientras que el promedio de la pápula al extracto de Capin melao fue de 5,8mm. En la tabla 1 se muestra que existió diferencias estadísticamente significativas p<0,001 en la positividad en pruebas cutáneas entre el extracto comercial de pólenes IV y el de Capin melao. Siendo mayo para Mellinis minutiflora, cabe destacar también la especificidad del extracto, ya que existe un importante grupo de pacientes que reaccionan específicamente a Capin y no a pólenes IV.
En Venezuela, son escasos los trabajos que reportan el papel de las diferentes gramíneas en el desarrollo de la patología alérgica. No obstante se ha reportado un incremento de las consultas de alergia durante los meses de octubre a marzo, meses que coinciden con los picos de floración de Mellinis minutiflora (Capriles Hulett et al., 2005). En el Distrito Capital, Melinis minutiflora (Capim melao) se encuentra de manera preponderante en el Parque Nacional el Ávila (Waraira Repano), ubicado en el área Centro-Norte de Venezuela, dentro del tramo central de la Cordillera de la Costa. Este se ubica a lo largo del Distrito Capital (paralelo a la costa) y en la región noroeste del Estado Miranda (Amend, 1991). En el Distrito Federal Mellinis minutiflora aparece generalmente a principios del mes de octubre y con las variaciones en los periodos de lluvia y sequia, la floración se puede extender hasta los meses de febrero a marzo (Ponce Perdomo, 1991).
Comenzamos inicialmente por recolectar la materia prima, extraer el polen de Mellinis minutiflora y preparar un extracto venezolano al que se le reporta actividad biológica de acuerdo a estándares internacionales. Los procesos de purificación y extracción permitieron elaborar un extracto local que fue utilizado para llevar a cabo un adecuado diagnóstico tanto in vivo como in vitro. El componente alergénico de los pólenes de las gramíneas se atribuye a una cantidad reducida de proteínas que se liberan rápidamente del grano de polen al hidratarse por contacto con las mucosas (Andersson y Lidholm, 2003). Los alergenos identificados presentan propiedades fisicoquímicas e inmunológicas similares. Actualmente se han descrito 11 grupos de alérgenos en poaceas (D'Amato et al., 1991). Las bandas encontradas en la electroforesis podrían relacionarse con los alérgenos de los grupos 1 (27 kDa), 2 (20 kDa), 4 (50kDa) y 5 (36 kDa). Estos han sido descritos previamente como alérgenos principales de algunas gramíneas (Weebwe, 2003). Valdría la pena evaluar la reactividad cruzada con otras especies de gramíneas y determinar el porcentaje de homología entre sus proteínas. El valor de actividad biológica obtenido en el extracto de Melinis minutiflora (Capim melao), fue de 48,20 UB/ml, demostrando una alta capacidad de inducir reconocimiento en prueba cutánea de los pacientes alérgicos venezolanos.
Este extracto fue presentado para la patente de registro ante el ministerio del poder popular para el comercio en el servicio autónomo de propiedad intelectual número 01422909.
No obstante, dado que hasta el momento, son escasas las investigaciones sobre el papel que ejerce Melinis minutiflora (Capim melao) en el desarrollo y exacerbación de la patología alérgica, nos propusimos investigar inicialmente cual era la prevalencia de la sensibilización en pruebas cutáneas, que son el parámetro Gold estándar de evaluación de los pacientes alérgicos, frente a esta gramínea y comparar con otros pólenes comerciales que no tienen a Mellinis dentro de su composición y que se emplean de forma rutinaria. Por esta razón incluimos el extracto comercial pólenes IV de la compañía española ALK bello y nuestro extracto localmente producido de Melinis minutiflora (Capim melao), en un grupo de 608 pacientes que acudieron a la Consulta de Alergia del Instituto de Biomedicina. Al determinar la prevalencia de sensibilización utilizando los pólenes comerciales que contiene las gramíneas Dactylis, Festuca, Lolium y Phleum, (ALK), se encontró un menor porcentaje de positividad comparado con nuestro extracto local. La positividad frente a Melinis minutiflora se ubicó en 22,03 % de sensibilización en una población de pacientes que acuden a la consulta de alergia, con un promedio de pápulas de los pacientes de 5,8 mm y superior al reportado en 1960 (Pinto, 1960). Adicionalmente evidenciamos un grupo importante de pacientes que reaccionan solamente al extracto de Melinis minutiflora y no al de otras gramíneas, reforzando la idea de una reactividad especifica de los mismos a esta especie.
Considerando que actualmente no se cuenta con un extracto comercial de esta gramínea que se aplique de forma rutinaria, y que esta tiene una amplia distribución a nivel mundial, se recomienda anexar el extracto alergénico de Melinis minutiflora (Capim melao), a la batería de extractos alergénicos para evaluar a los pacientes alérgicos. De igual forma, se sugiere continuar con nuevas investigaciones que permitan en un futuro cercano, utilizar extractos de esta gramínea para elaborar vacunas que sean usadas en la IT en los individuos atópicos, lo cual mejoraría la calidad de vida de estos pacientes.
Se agradece la colaboración del personal del Laboratorio de Inmunopatología del Instituto de Biomedicina en especial a la Sra. Trina Amundaray, la TSU Emperatriz Mata, al técnico de laboratorio Nelson Vazquez y a la licenciada María Elena Roque por su colaboración con el manejo de los pacientes de la Consulta de alergia. A los estudiantes de pregrado de Biología y especialización de inmunología clínica de laboratorio, UCV. Al Ingeniero Luis Castejón por su colaboración para la recolección y selección de la gramínea. Al fonacit por el financiamiento en el marco del proyecto 20122001253.