Anopheles nuneztovari Gabaldon 1940, es considerado el principal vector de malaria en la región andina, recientemente ha sido reportado en el estado Bolívar, donde se produce más de 60% de la malaria en Venezuela. Se propuso como objetivo estudiar el comportamiento de An. nuneztovari s.l. de Las Manacas, municipio Sifontes, en el estado Bolívar, frente a los cuatro grupos toxicológicos de insecticidas (organofosforados, organoclorados, carbamatos y piretroides) y determinar los posibles mecanismos de resistencia a insecticidas involucrados, por medio de pruebas biológicas en botellas, pruebas bioquímicas en microplacas y electroforesis. Anopheles nuneztovari s.l. resultó resistente a los insecticidas fenitrotion, pirimifosmetily DDT, pero susceptible a propoxur, lambdacialotrina y deltametrina. Este fenómeno fue confirmado por pruebas bioquímicas observándose valores elevados de acetilcolinesterasa insensible (0,1083), al mismo tiempo que valores normales para la acetilcolinesterasa (0,1095), esterasas α (0,4930), esterasas β (0,5293) y oxidasas de función múltiple (0,1215). Estos resultados fueron comprobados en las electroforesis, observándose bandas bien definidas y fuertemente teñidas tanto de esterasas A4 como de B2, las cuales han sido reportadas como mecanismos de resistencia en vectores de enfermedades. Estos hallazgos contribuyen al planteamiento de nuevas estrategias para el buen uso y prolongación de la vida útil de los insecticidas.
Palabras clave: Anopheles nuneztovari; esterasas; oxidasas; resistencia a insecticidas; Malaria; Venezuela.
Anopheles nuneztovari Gabaldon 1940, is considered the main vector of malaria in the Andean region, has recently been reported in the Bolívar state, where more than 60% of malaria is produced in Venezuela. The objective was to study the behavior of An. nuneztovari s.l. of Las Manacas, municipality Sifontes, in the Bolívar state, in front of the four toxicological groups of insecticides (organophosphorus, organochlorine, carbamates and pyrethroids) and to determine the possible mechanisms of resistance to insecticides involved, by means of biological tests in bottles, biochemical tests in microplates and electrophoresis. Anopheles nuneztovari s.l. It was resistant to insecticides fenitrothion, pirimiphosmethyl and DDT, but susceptible to propoxur, lambda-cyhalothrin and deltamethrin. This phenomenon was confirmed by biochemical tests observing high values of insensitive acetylcholinesterase (0.1083), at the same time as normal values for acetylcholinesterase (0.1095), esterases α (0.4930), esterases β (0.5293) and multiple function oxidases (0.1215). These results were checked in the electrophoresis, observing well defined and strongly stained bands of both A4 and B2 esterases, which have been reported as resistance mechanisms in disease vectors. These findings contribute to the approach of new strategies for the good use and prolongation of the useful life of the insecticides.
Key words: Anopheles nuneztovari; esterases; oxidases; resistance to insecticides; Malaria; Venezuela.
Anopheles nuneztovari Gabaldon s.l. se encuentra distribuida en sur América desde Venezuela hasta Brasil (Sinka et al, 2012). Hasta 2004 se pensó que la especie estaba confinada a las regiones del oeste de Venezuela, asociada a la ecoregión de piedemonte andino, hallándosele ocasionalmente en los llanos y bosques interiores en tierras bajas (Osborn et al., 2004; Rubio-Palis, 2000); sin embargo, Moreno et al., (2004) la colectaron en tres localidades del municipio Sifontes en el estado Bolívar. Esta especie se encuentra en zonas con altitudes que van desde 200 hasta 1352 msnm, con precipitaciones y temperaturas medias anuales de 1000 a 4000 mm de lluvia y 25 a 28 ºC (Sinka et al, 2010); siendo considerado el principal vector de malaria por P. vivax en el occidente de Venezuela (y norte de Colombia así como de P. falciparum en Surinam durante las epidemias (Panday 1977). Fue encontrado por primera vez infectado en la naturaleza con Plasmodium spp. por Rey y Renjifo (1950). Anopheles nuneztovari s.l. ha sido encontrada naturalmente infectada con Plasmodium en Brasil (Arruda et al., 1986; Póvoa, 1993; Tadei et al., 1998), Colombia (Brochero, et al., 2007) y Perú (Hayes et al., 1987); mientras que en Venezuela la infección ha sido reportada por Pintos y Sabril (1965), Pintos et al., (1968) y Rubio-Palis et al., (1992), siendo el último reporte el de Abou Orm et al. (2017) en el municipio Sifontes del estado Bolívar. Gabaldón y Guerrero (1959) observaron que en algunas áreas donde An. nuneztovari estaba transmitiendo malaria los índices esplénicos eran cercanos a 100%. Hamon et al., (1970) también señalaron que la importancia de este vector dependía de la densidad de vegetación en los alrededores de las casas, reduciéndose la densidad del vector cuando la vegetación peridoméstica se eliminaba. Esta especie es antropofílica y las hembras abandonan las casas poco después de alimentarse de sangre, por consiguiente al no reposar sobre las paredes evitan ponerse en contacto con dosis letales de insecticidas. Gabaldón (1972) consideraba que esta intensa exofilia ha sido responsable en gran medida de la malaria "refractaria" en Venezuela.
Para 2017 La Incidencia Parasitaria Anual (IPA) del país fue de 21,7 por cada 1.000 habitantes (MPPS, 2017). El control exitoso de la malaria se basa en la integración de las medidas de educación sanitaria hacia la comunidad, orientadas a crear conciencia sobre la protección individual y aquellas medidas llevadas a cabo por los Programas de control, dirigidas a actuar sobre los vectores y sobre el parásito. Sin embargo, las estrategias de control en malaria, no pueden ser estáticas, en virtud de las capacidades adaptativas de los parásitos a los medicamentos y los vectores a los insecticidas (Wide, et al., 2011). El control de mediante rociamiento residual intradomiciliario y el uso de mosquiteros insecticidas de larga duración, seguirá siendo fundamental, desafortunadamente, debido a la presión, los mosquitos siguen desarrollando resistencia a los insecticidas. Se ha identificado resistencia a insecticidas en los anofelinos vectores de malaria en 64 países con transmisión activa de la enfermedad, afectando todas las regiones del mundo, detectándose en algunas áreas, resistencia a las cuatro clases de insecticidas utilizados en salud pública para el control de vectores (IRAC, 2011). La comunidad mundial para el control de la malaria ha tomado en serio esta amenaza, el Plan Mundial para el Manejo de la Resistencia a Insecticidas en los vectores de malaria (GPIRM, por sus siglas en inglés) advierte sobre la necesidad de actuar antes que este problema ponga en peligro las estrategias actuales de control de vectores (OMS, 2012).
La población objeto de estudio fue An. nuneztovari sl de la localidad de Las Manacas (6º 12´ 24” N; 61º 22´ 40” O; fig. 1) ubicada en la parroquia San Isidro del municipio Sifontes en el estado Bolívar.
La muestra estuvo constituida por mosquitos hembras adultas de esta especie colectadas entre las 18:00 y 20:00 horas, reposando sobre vaqueras y paredes de las viviendas a una frecuencia de dos veces por semana de septiembre a diciembre de 2017. No se contó con una cepa patrón susceptible a insecticidas, de la especie.
Se evaluaron el organoclorado DDT (98%), los organofosforados fenitrotion (95%) y pirimifosmetil (89,08%); los piretroides lambdacialotrina (70%) y deltametrina (70%) y el carbamato propoxur (99,3%), los insecticidas grado técnico sin valor comercial que fueron suministrados por Insecticidas Internacionales Compañía Anónima INICA.
Los bioensayos se realizaron siguiendo el método de las botellas del CDC (Center for Disease Control and Prevention, Atlanta, USA). Los mosquitos adultos hembras colectados fueron expuestos a botellas de vidrio tipo Wheaton de 250 ml, tratadas con soluciones cetónicas de insecticidas, las cuales fueron usadas como cámaras de prueba para detectar la resistencia a los insecticidas en mosquitos adultos, para los ensayos se emplearon las dosis recomendadas por la OMS (2016) que señala la dosis diagnóstica como la menor de la dosis que mata el mayor porcentaje de los insectos expuestos. Las botellas controles del experimento solo fueron tratadas con acetona. Los ensayos se realizaron a temperaturas aproximadas de 26°C ± 2 y humedad relativa de 75% ± 5. Se expusieron aproximadamente 10 mosquitos adultos (♀) por botella y se evaluaron cuatro repeticiones por cada concentración de insecticida y dos repeticiones como grupo control. Los ensayos fueron replicados tres veces en días distintos, durante el tiempo que se lograba el 100% de mortalidad. De esta manera se determinó el efecto del insecticida en función del tiempo de exposición, Con esta misma metodología se procedió para los bioensayos con los sinergistas.
Cada mosquito fue homogeneizado en 50 μl de amortiguador fosfato y diluido a 0.5 ml del mismo amortiguador. Se tomaron alícuotas de 50 μl de cada muestra y se colocaron en placas para microtitulación de 96 pocillos. Se evaluaron seis diferentes enzimas que confieren resistencia a insecticidas; esterasas α y β, multifunción oxidasa (MFO), glutation-S-tranferasa (GST), acetilcolinesterasa (AChe) y acetilcolinesterasa insensible (AChei). Los substratos utilizados en cada ensayo incluyen α y β-naftil acetato para las esterasas no específicas, el TMBZ (3,3`,5,5`-Tetrametil Benzidina) para las oxidasas (hemo peróxidasa) y el yoduro de acetilcolina usado para medir la actividad de la acetilcolinesterasa normal, para la acetilcolinesterasa insensible se añadió el insecticida carbamato propoxur a la muestra. La absorbancia fue medida en un lector de ELISA, Multiskan Plus de Fisher Scientific, empleando filtros de 405 nm para AChe y AChei, mientras que para las esterasas y oxidasas se empleó filtro de 620 nm (Hemingway y Brogdon, 1998).
Siguiendo el procedimiento descrito por García- Segua, se prepararon las muestras en una proporción de 1:1; 10 μl de homogenato con 10 μl de amortiguador de carga para un total de 20 μl. Luego se preparó el gel tampón colocándolo en la placa y se esperó la polimerización del mismo. Seguidamente se preparó el gel de corrida, añadiéndolo a la placa nuevamente, colocando el peine separador. Una vez ocurrida la polimerización se retiró el peine, y el gel del soporte. Se llenó la cámara con amortiguador de corrida, luego se colocó el gel dentro y las muestras en cada pocillo correspondiente. La corrida se realizó a 150 voltios aproximadamente 1 hora u 1 hora y 20 minutos. Pasado el tiempo se sacó el gel y se colocó en un recipiente contentivo de 50 ml de substrato, se incubó por 20 minutos para luego añadir el colorante Fast Blue por 5 minutos, enjuagar y sumergirlo en solución fijadora 50 ml por 20 minutos; después se procedió a secar a 80ºC por 1 hora y 45 minutos, por último se retiró el gel y se cuantificaron las bandas.
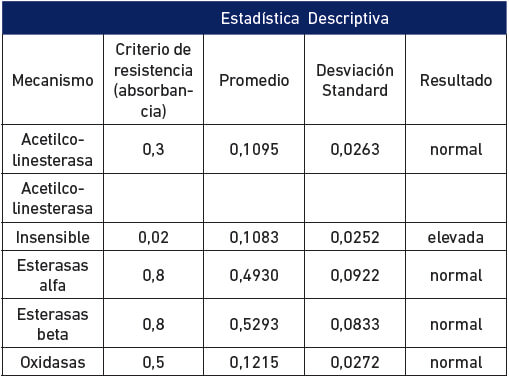
Los datos obtenidos con las pruebas biológicas fueron sometidos a un análisis de regresión y correlación lineal probit, donde se determinaron los tiempos letales 50 y 98 (TL50 y TL98), así como la pendiente de la recta y el X2 y graficados en el programa Excel, empleando una curva sigmoidal de porcentaje de mortalidad versus tiempo en minutos, Los resultados obtenidos en las pruebas bioquímicas de la acetilcolinesterasa, acetilcolinestarasa insensible, esterasas elevadas y multifunción oxidasa, fueron analizados en función de los valores de absorbancias según el siguiente criterio: valores de absorbancia por encima de 0,3; 0,02; 0,8 y 0,5 respectivamente, son considerados como evidencia de presencia del mecanismo en concordancia con los resultados de los bioensayos con insecticidas. Para Identificación de esterasas por electroforesis, se determinó la razón de movilidad (Rf= distancia de migración de la banda/ distancia de migración del indicador xileno cianol) y se buscó identificar las esterasas A4 (Rf= 0,7) y B2 (Rf= 0,2), que han sido reportadas como mecanismo de resistencia en otras especies de importancia médica (Georghiou y Pasteur, 1978).
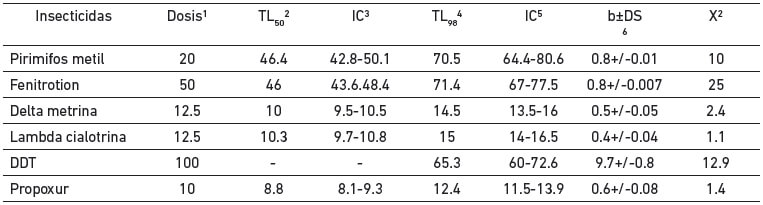
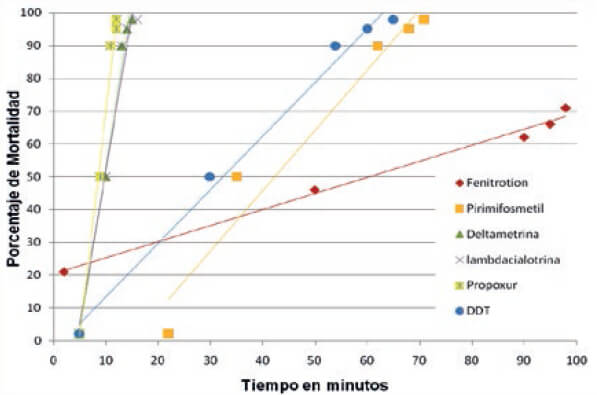
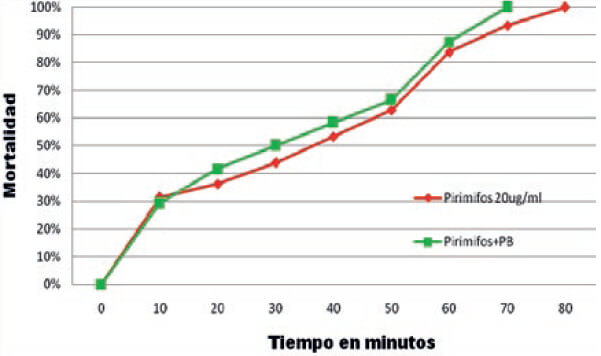
Se determinó el efecto del insecticida en función del tiempo de exposición en comparación al umbral de resistencia categorizando los mosquitos como resistentes o susceptibles. En el tratamiento control no se encontró mortalidad por lo que no fue necesario corregir. La relación tiempo (dosis) mortalidad de los especímenes de An. nuneztovari s.l. de Las Manacas, expuestos al órgano clorado DDT y los organofosoforados fenitrotion y pirimifosmetil, evidencian resistencia, mientras que los expuestos al insecticida piretroide deltametrina y al carbamato propoxur resultaron susceptibles (tabla I, figura 2), por cuanto 100 % de los individuos expuestos murieron entre 15 y 20 minutos, con relación al umbral referencial para la especie de 30 minutos, determinado por Fonseca-González et al (2010). Adicionalmente, se observó sinergismo del butóxido de piperonilo con el pirimifosmetil (figura 3), más no con la deltametrina (figura 4). Este fenómeno fue confirmado por las pruebas bioquímicas donde se observaron valores elevados en absorbancia de acetilcolinesterasa insensible (0,1083), pero valores normales en acetilcolinesterasa (0,1095), esterasas alfa (0,4930), esterasas beta (0,5293) y oxidasas de función múltiple (0,1215) (tabla II). Asimismo, esto fue comprobado en las electroforesis, en las cuales se pudo observar bandas bien definidas y fuertemente teñidas tanto de esterasas A4 (figura 5), como de B2 (Figura 6), que también sugieren mecanismos de resistencia basados en estas enzimas.
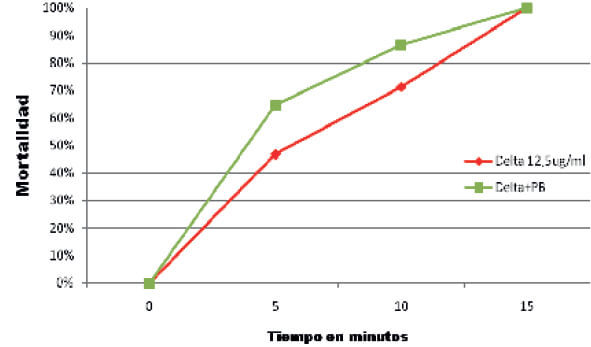
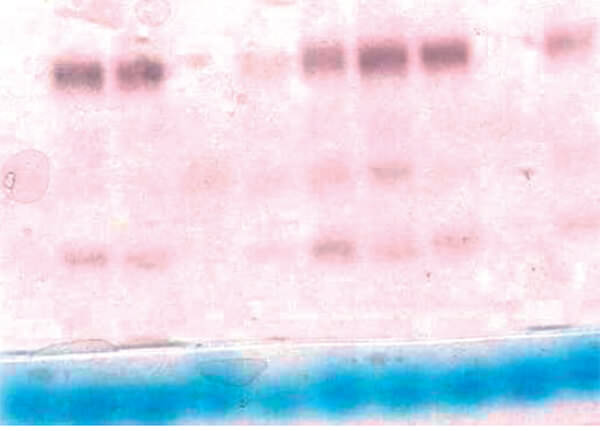
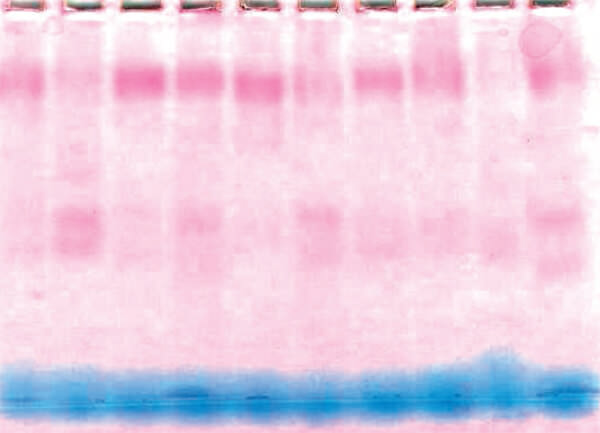
(Figuras 5 y 6: No se pudo disponer de una mejor resolución de la imagen por parte de los autores)
Anopheles nuneztovari s.l. del estado Bolívar, se fue encontrado resistente al organoclorado DDT y a los organofosforados pirimifosmetil y fenitrotion, mientras que sigue respondiendo de manera favorable a los piretroides deltametrina y lambdacialotrina y al carbamato propoxur. La resistencia encontrada posiblemente esté siendo mediada por la acetilcolinesterasa insensible y las esterasas A4 y B2 reveladas en la electroforesis. Existen reportes de especies de anofelinos en diferentes regiones del mundo, que todavía son susceptibles a los insecticidas piretroides, pero resistentes a los organofosforados por ejemplo en Venezuela, Figueroa Acosta et al. (2006) publicaron un estudio en An. aquasalis de Aragua en el cual se determinó su nivel de resistencia a lambdacialotrina y a pirimifosmetil, además se identificaron mecanismos de resistencia in vivo con los sinergistas Butóxido de Piperonilo (PB) y S, S, S, Tributilfosforotriotioato (DEF) e in vitro con el substrato beta naftil acetato. Las enzimas de multifunción oxidasa (MFO) y las esterasas pudieran estar interviniendo en la resistencia encontrada a estos insecticidas.
También Molina de Fernández et al (2007) describen el nivel de resistencia a insecticidas organosintéticos en albitarsis s.l. (=marajoara Galvão & Damasceno, 1942), en estudios realizados en zonas agrícolas de Calabozo, en el estado Guárico, donde hay brotes de malaria, esporádicos, con metodología combinada OMS y CDC, con la cual también se determinaron mecanismos de resistencia a insecticidas in vivo e in vitro. Las poblaciones adultas de An. albitarsis s.l. de esta zona mostraron resistencia cruzada entre DDT y piretroides, entre piretroides y a los organofosforados evaluados. En este caso, la resistencia a piretroides y organofosforados fue fuertemente reducida por el sinergista butóxido de piperonilo demostrando la presencia de multifunción oxidasas. Las pruebas bioquímicas indicaron aumento en el nivel de enzimas esterasas no especificas, y hubo evidencia de acetilcolinesterasa insensible. Estos resultados fueron discutidos en términos de resistencia múltiple a insecticidas, reportada por primera vez para esta especie y en la cual el uso de insecticidas se encuentra claramente comprometido con la aplicación de insecticidas en la agricultura, debido a que esta especie de importancia epidemiológica habita ecosistemas de arrozales. Del mismo modo, Fonseca-González et al., 2009, a fin de establecer el estatus de susceptibilidad para An. darlingi de Colombia, condujeron ensayos bioquímicos en microplacas, encontrando niveles elevados de enzimas, relacionados con la resistencia a insecticidas que incluyen MFO, NSE, GST y Achei. El metabolismo incrementado a través de MFO y NSE, pudiera estar envuelto en la resistencia cruzada a DDT y lambdacialotrina. Nuevamente, González et al., (2009a), reportaron para An. nuneztovari, evidencia de algunos mecanismos de resistencia tales como OFM y Achei, que implica resistencia cruzada entre DDT y piretroides, también se reportó resistencia a fenitrotión. Esta resistencia encontrada a estos insecticidas, es debido a que son los más comúnmente usados por las autoridades de salud para el control de los vectores de malaria. Por último, Molina de Fernández y Figueroa Acosta (2009), señalan resistencia metabólica en An. aquasalis del municipio Libertador, Sucre. Se detectaron niveles elevados de esterasas alfa y beta, así como también la Acetilcolinesterasa alterada. Las enzimas oxidasas de función múltiple en las poblaciones de An. aquasalis de tres de las localidades evaluadas también resultaron alteradas, por lo que ambos sistemas enzimáticos pudieran estar interviniendo en la expresión de resistencia a insecticidas organofosforados en las poblaciones de estudio. Por otro lado, la actividad enzimática de la Glutation-Stransferasa solo está operando en Río de Agua, esto podría explicarse, por cuanto la zona ha sido sometida a fuerte presión con insecticidas organoclorados, en el pasado, específicamente el DDT, ejercida por los organismos de salud en esa zona para el control de la malaria.