Con el objetivo de evaluar la eficacia terapéutica in vivo, de los medicamentos antimaláricos de primera línea, fueron estudiadas 80 personas: 40 diagnosticadas con Plasmodium vivax, a quienes se aplicó tratamiento con Cloroquina+Primaquina durante 14 días, y 40 infectadas a Plasmodium falciparum, tratadas con Artemeter/Lumefantrina + Primaquina, durante 4 días. 51 pacientes (63,8%) fueron del sexo masculino y 29 pacientes (36,3%) del femenino, de edades entre 11 y 76 años. El mayor grupo etario fue el de 20-29 años (28,8%). Los mineros ocuparon el primer lugar entre los infectados (31,3%). Fue utilizado el “Protocolo genérico para estudios in vivo de eficacia de los medicamentos antimaláricos en las Américas”, con seguimiento de 28 días. La respuesta clínica y parasitológica adecuada del grupo fue de 66,3%, siendo 40% para Cloroquina+Primaquina, y 92,5% para Artemeter/Lumefantrina; con 22,5% de fracaso terapéutico precoz, 22,5% de fracaso tardío al tratamiento y 15% de fracaso parasitológico tardío en Cloroquina+Primaquina, y 2,5%, 5%, 0, respectivamente para Artemeter/Lumefantrina. El valor de la respuesta clínica y parasitológica adecuada para P. falciparum fue aceptable, mientras que para P. vivax hace imperiosa la necesidad de buscar una combinación sustituta, con mayor eficacia, creando y manteniendo un sistema de vigilancia farmacológica para cualquier medicamento en el área de estudio.
Palabras clave: Malaria; Eficacia terapéutica; malaria; medicamentos; Plasmodium vivax; Plasmodium falciparum.
In order to evaluate the in vivo therapeutic efficacy of first-line antimalarial drugs, 40 people diagnosed with Plasmodium vivax were studied, who were treated with Chloroquine + Primaquine for 14 days and 40 infected with Plasmodium falciparum, treated with Artemeter/Lumefantrine + Primaquine, for 4 days. 51 patients (63.8%) were male and 29 patients (36.3%) female, aged between 11 and 76 years. The largest age group was 20-29 years (28.8%). The miners occupy the first place among the infected (31.3%). The "Generic protocol for in vivo studies of efficacy of antimalarial drugs in the Americas" was used, with a 28-day follow-up. The adequate clinical and parasitological response of the group was 66.3%, being 40% for Cloroquine+Primaquine, and 92.5% for Artemeter/Lumefantrine; with 22.5% of early therapeutic failure, 22.5% of late failure to treatment and 15% of late parasitological failure in Chloroquine + Primaquine, and 2.5%, 5%, 0, respectively, for Artemeter/ Lumefantrine. The value of the adequate clinical and parasitological response for P. falciparum was acceptable, while for P. vivax it is imperative that a substitute combination be sought, with greater efficacy, maintaining continuous monitoring for any combination in the study area.
Key words: Therapeutic efficacy; malaria; drugs; Plasmodium viva; Plasmodium falciparum.
Entre las enfermedades parasitarias, el paludismo o malaria es la más importante si se tiene en cuenta el número de individuos que enferman anualmente y el impacto socio-económico que representa (Machado, 2011). En 2016, se estimó una incidencia de 216 millones de casos de paludismo en todo el mundo, la mayoría registrados en África, Asia Sudoriental y el Mediterráneo Oriental. De los 91 países que informaron casos de paludismo autóctono en el año, 15 de ellos, todos en el África Subsahariana, contabilizaron 80% de la carga mundial de paludismo. Se estima que la tasa de incidencia del paludismo disminuyó en 18% a nivel mundial, de 76 a 63 casos por cada un mil habitantes en riesgo, entre 2010 y 2016. A pesar de estas reducciones, entre 2014 y 2016 la tendencia en la incidencia de casos se incrementó sustancialmente en las Américas, y marginalmente en las regiones de Asia Sudoriental, Pacífico Occidental y África (OMS, 2017).
El reto propuesto por la Asamblea Mundial de la Salud dentro del programa “Hacer Retroceder la Malaria” (RBM), era disminuir para el año 2015, hasta 75%, el número de casos de malaria registrados en el año 2000, y reducir las muertes a casi cero. Como resultado, 57 países y territorios redujeron la incidencia de casos de la enfermedad disminuir para el año 2015, hasta 75% (OMS, 2016).
Igualmente, la Organización Mundial de la Salud (OMS), en su “Informe Mundial 2015 sobre el Paludismo”, señaló que 106 países y territorios presentaron transmisión activa de la enfermedad en el año 2000, mientras que a finales de 2015 hubo 95.
También informó que el número de casos se redujo de aproximadamente 262 millones a nivel mundial el año 2000, a 214 millones en 2015, un descenso de 18%. A su vez, las muertes por paludismo disminuyeron en el período, de 839.000 a 438.000, un descenso de 48%, indicando además, que la mayoría de los casos y muertes reportados en 2015 ocurrieron en la Región Africana (88%), seguida por la Región de Asia Sudoriental. Se estimó también, que la incidencia por paludismo que tiene en cuenta el crecimiento demográfico, disminuyó 37% a nivel mundial entre el 2000 y 2015 y la tasa de mortalidad disminuyó 60%, por lo cual se alcanzó la meta “6C” del componente paludismo de los Objetivos del Milenio” (OMS, 2016).
En el caso de Venezuela, el reto a cumplir, era pasar de los 30.234 casos en 2000 a 7.559 casos en 2015 (Cáceres, 2013). Sin embargo, para este último año la incidencia malárica fue de 136.402 casos, lo cual significó un aumento de 451,2% con referencia al año 2000.
Para el año 2016, según el “Boletín” de la Semana Epidemiológica 52, publicado por el Ministerio del Poder Popular para la Salud (MPPS), fueron diagnosticados en Venezuela, 240.613 casos, que representaron un aumento de 76,4% respecto al período homólogo del año anterior. La Incidencia Parasitaria Anual (IPA) del país fue 21,7 casos por cada un mil habitantes, el Índice Anual de Exámenes de Sangre (IAES), fue 7,7% y el Índice de Láminas Positivas acumulativo (ILP) fue 28,5%.
Según el origen de infección, correspondieron al estado Bolívar 177.619 casos originados en su territorio, cifra que ubicó al estado por catorceavo año consecutivo en el primer lugar de la incidencia malárica, representando 73,8% de los casos del país y un aumento de 70.766 (66,2%) de la casuística respecto al año 2015. Junto con los estados: Amazonas (10,4%), Sucre (8,7%), Delta Amacuro (3,9%), Monagas (2,1%) y Zulia (0,7%), originaron 99,6% de la incidencia de la enfermedad.
La fórmula parasitaria de los diagnósticos maláricos en el estado fue: 69,1% a Plasmodium vivax (P. vivax), 25,8% a Plasmodium falciparum (P. falciparum), y 5,1% de infecciones mixtas (P. vivax + P. falciparum). De sus 11 municipios, 10 municipios del estado Bolívar son de alta incidencia malarica y son productores de la enfermedad, destacándose el municipio Sifontes, el cual aportó en el período, 102.543 casos, que representaron 57,7% de la frecuencia de la malaria en el estado y 42,6% de la incidencia nacional. La parroquia San Isidro del municipio Sifontes, concentró 78.450 casos de la enfermedad, producidos en 264 lugares, en su mayoría campamentos mineros, representando 76,5% de las infecciones del municipio, 44,2% del estado y 32,6% del país.
Como es conocido, la problemática de la incidencia malárica mundial es de origen multicausal, en la que actúan como factores importantes las deficiencias administrativas, logísticas y económicas del programa control, actividades no supervisadas, ausencia de toma de decisiones, análisis situacional inexistente, problemas políticos, la variabilidad del clima, resistencia de los vectores a los insecticidas, problemas de acceso al programa, coberturas diagnósticas deficientes, tratamientos incompletos y resistencia a las drogas antimaláricas.
Entre los últimos factores, un problema que ha aumentado con el tiempo en el programa antimalárico venezolano, es el aparente diagnóstico de casos recidivantes. Durante el año 2016, fueron registrados sólo en el municipio Sifontes, 53.072 recaídas (reaparición de parasitemia asexual en malaria por Plasmodium vivax derivada de formas hepáticas persistentes), y 2.758 recrudescencias (reaparición de parasitemia asexual a Plasmodium falciparum), para ambos clasificaciones, en los 30 días siguientes a la fecha de culminación del tratamiento inicial.
Es importante mencionar, que esta incidencia denominada por el programa “caso anterior”, por considerar que se trata del caso diagnosticado inicialmente a la persona (que no se cura luego de ser tratado), no son sumados en la estadística del municipio, hallándose cifras no publicadas, semejantes a la incidencia o “caso nuevo”. Dichos casos podrían tener como causas: inadecuado dosificación del tratamiento (dosificación no acorde con el peso), baja adherencia al tratamiento (tratamiento no terminado o incompleto), error de diagnóstico (error de especie o infección mixta), o resistencia a los medicamentos administrados o suministrados por el programa. de malaria, el objetivo primordial del tratamiento antimalárico consiste en lograr la eliminación rápida y completa del plasmodio de la sangre del paciente, para prevenir que el paludismo no complicado evolucione hacia la enfermedad grave, la defunción o la infección crónica, que produce la anemia relacionada con el paludismo. Desde una perspectiva de Salud Pública, el tratamiento se administra para reducir la transmisión de la infección a otras personas mediante la reducción del reservorio infeccioso y para prevenir el surgimiento y la propagación de la resistencia a los medicamentos antipalúdicos (OMS, 2016).
Desde cuando el P. falciparum resistente a la Cloroquina fue reportado por primera vez en Tailandia (1959) y Colombia (1961), la resistencia a las drogas antipalúdicas se volvió uno de los más importantes problemas en el control de la enfermedad en los años recientes. Varias cepas de P. falciparum muestran ahora resistencia a todas las drogas antipalúdicas comúnmente usadas, excepto a la Artemisinina y sus derivados (Wilson et al. 2006).
La OMS ha definido la resistencia a los medicamentos antimaláricos, como la capacidad de una cepa parasitaria de sobrevivir y/o multiplicarse a pesar de la administración y absorción de una droga dada a dosis iguales o mayores que aquellas usualmente recomendadas, pero dentro de los límites de tolerancia del sujeto (WHO, 2006), y a fines de los años noventa del siglo pasado, el sistema de vigilancia de RAVREDA-AMI consistió en la evaluación de la eficacia terapéutica de los antimaláricos mediante la aplicación de un protocolo estandarizado, basado en sus recomendaciones, a una muestra de pacientes que acudieran en búsqueda de atención, en los puntos de diagnóstico de malaria del sistema de salud, identificados como sitios centinela (SC) (OPS, 2017).
Aunque una parte de la historia de la malaria corresponde a un extenso capítulo de éxitos y fracasos terapéuticos con diversos medicamentos que fueron presentados en el momento de su descubrimiento como la solución milagrosa y que pocos años más tarde se vio que no lograron cumplir las expectativas, en la primera década del siglo XXI, la OMS decidió cambiar los lineamientos del tratamiento del paludismo a Plasmodium falciparum, mediante la introducción de Combinaciones Terapéuticas con Derivados de la Artemisinina (CTDA), como una estrategia para retrasar la aparición de la resistencia (Sebbag, 2011).
Los tratamientos señalados que combinan dos principios activos con diferentes mecanismos de acción, son los más eficaces en este momento. Actualmente, la OMS recomienda cinco tratamientos combinados basados en la Artemisinina para combatir el paludismo por Plasmodium falciparum. La elección de uno u otro deberá realizarse en función de los resultados de los estudios de eficacia terapéutica contra las cepas locales de P. falciparum. Cerca de 95% de los países considerados endémicos para malaria por Plasmodium falciparum, en 2009, habían adoptado como po lítica nacional la administración de las CTDA (OMS, 2016).
Al presente, las combinaciones basadas en la Artemisinina, constituyen la piedra angular de las pautas terapéuticas recomendadas contra el paludismo por Plasmodium falciparum y como tal, es necesario preservar su eficacia. La OMS recomienda a los programas de lucha contra el paludismo, controlar periódicamente la eficacia de los medicamentos antipalúdicos en uso, para comprobar que los tratamientos seleccionados continúen siendo eficaces. En zonas con baja transmisión se añadirá al tratamiento antipalúdico una dosis baja y única de Primaquina, a fin de reducir la transmisión de la infección. No son necesarias pruebas de detección del déficit de glucosa-6-fosfato- deshidrogenasa (G6PD), dado que las dosis bajas y únicas de Primaquina son eficaces para bloquear la transmisión, pero tienen pocas probabilidades de producir toxicidad grave en pacientes con cualquier variante del déficit de G6PD (OMS, 2016).
En Venezuela, hace más de 10 años el MPPS, teniendo en cuenta que mediante la combinación de antimaláricos con diferentes mecanismos de acción se puede prevenir o retardar la aparición de resistencia, y con el fin de garantizar altas tasas de curación a través de la adherencia a regímenes con dosis correctas de medicamentos, propuso como política el uso de Cloroquina + Primaquina para el tratamiento de malaria por Plasmodium vivax y años más tarde, Artemeter/ Lumefantrina + Primaquina, para Plasmodium falciparum en todo el territorio nacional.
Dado el aumento de los casos de malaria, el hecho que los medicamentos no hayan sido evaluados por más de 8 años, y la cantidad de personas que no se curan con el tratamiento de elección, o infecciones maláricas reportadas como “caso anterior”, hizo necesario determinar el grado de eficacia de las pautas terapéuticas antimaláricas establecidas por el MPPS, aplicando los instrumentos recomendados por la OMS.
Fue realizado un estudio descriptivo de campo, experimental, sobre la eficacia terapéutica de los medicamentos antimaláricos de primera línea: Cloroquina + Primaquina para Plasmodium vivax, y Artemeter/Lumefantrina + Primaquina para Plasmodium falciparum, en el estado Bolívar, Venezuela.
La población estuvo conformada por pacientes procedentes del municipio Sifontes, quienes acudieron al puesto de diagnóstico CD-36 en Ciudad Bolívar, con sintomatología de malaria entre junio y septiembre de 2017. La muestra fue calculada con base en 45.000 habitantes del área minera del municipio, una IPA de 700/1000, mínimo valor aceptable 60%, nivel de significancia 95%, poder de 80%, para un total de 80 personas, las cuales fueron seleccionadas mediante muestreo no probabilístico (40 por P. vivax y 40 por P. falciparum).
Como criterios de inclusión, se observaron: pacientes entre 6 meses y 80 años de edad, infección única por P. falciparum o P. vivax, recuento de parasitemia mayor de 250 y menor de 50.000 formas asexuales/ml, disponibilidad de asistir a los seguimientos durante 28 días y aceptar participar en el estudio mediante la firma de consentimiento informado. Fueron excluidas las embarazadas o mujeres lactando (se practicó prueba de embarazo a mujeres en edad fértil), pacientes con signos de peligro o de malaria grave, enfermedad crónica subyacente (cardíaca, renal, hepática o malnutrición), y presencia de enfermedad concomitante que requiriese tratamiento adicional con medicamentos de efecto antimalárico.
La investigación fue concebida según las pautas del “Protocolo genérico para estudios in vivo de eficacia de los medicamentos antimaláricos en las Américas”, utilizado por la “Red Amazónica de Vigilancia de la Resistencia a los Antimaláricos (RAVREDA), aportado por la Organización Panamericana de la Salud. (WHO, 1996).
Todo paciente febril que acudió al puesto de diagnóstico en Ciudad Bolívar, se le practicó una gota gruesa. Al paciente con gota gruesa positiva para P. vivax o P. falciparum, se le comunicaban los objetivos del estudio, en qué consistía y se le invitaba a participar en el mismo. A los que estuvieron de acuerdo en participar, se le solicitó la lectura y posterior firma del formulario de consentimiento informado.
Una vez observados los criterios de inclusión y exclusión, y firmado el consentimiento informado se procedió de la siguiente manera:
El medicamento fue obtenido del Programa Antimalárico de la Dirección de Salud Ambiental del MPPS, en el estado Bolívar. Las dosis fueron administradas bajo supervisión del personal de la investigación y se observó al paciente por 30 minutos.
Infección por Plasmodium vivax: combinación de Cloroquina + Primaquina:
Cloroquina: Dosis total: 25 mg base por kg. peso para administrar en tres (3) días.
Primaquina: Dosis total: 3,5 mg base por kg peso, para administrar en catorce (14) días consecutivos, a razón de 0,25 mg /Kg/Peso por 14 días.
Infección por Plasmodium falciparum no complicada: Se indica como pauta terapéutica de primera línea para infecciones por P. falciparum la combinación de Artemeter/Lumefantrina y Primaquina.
Artemeter/Lumefantrina: Tableta combinada 20mg/120mg. Administración establecida con relación al peso del paciente durante 3 días continuos, cada 12 horas. Contraindicado en menores de 10 kg, embarazadas y lactantes.
Primaquina: Dosis total: 0,75 mg base por kg peso, en dosis única administrada el día cuatro (4) del tratamiento. Contraindicado en menores de 10 kg, embarazadas y lactantes (MPPS, 2015).
Proceso de seguimiento: a los pacientes que recibieron cualquiera de las dos combinaciones de tratamiento, se les pidió regresar los días: 1, 2, 3, 7, 14, 21 y 28. En su defecto, el paciente fue ubicado en su sitio de residencia.
Seguridad de los pacientes: Para evaluar la tolerabilidad del medicamento, fueron registrados los efectos secundarios reportados por los pacientes de manera espontánea, sin preguntar por ellos específicamente para evitar inducir algún tipo de respuesta.
Pérdida del seguimiento: Se consideró como pérdida, cuando a pesar de esfuerzos razonables del equipo de investigación, un paciente no pudo ser encontrado para su seguimiento. También correspondió a los pacientes que se ausentaron del área de estudio y perdieron una o más de las visitas de seguimiento.
El retiro del estudio fue voluntario, cuando el paciente decidía no participar más en el mismo. A continuación se presentan los criterios utilizados como retiro de paciente:
La valoración del protocolo ocurre cuando un paciente es removido del estudio por alguna causa que no permite una adecuada interpretación de la respuesta al tratamiento. Por ejemplo cuando ocurre un error en la dosificación del medicamento, cuando se detecta una infección mixta durante el seguimiento o cuando se reporta el uso de otro antimalárico durante el seguimiento.
Para el manejo y análisis de datos fue utilizado el programa Epi Info. Fue calculado el número y proporción de pacientes con respuesta de (FTP) (Clo+Pri), (FTP) (Art/Lum+Pri), (FCT) (Clo+Pri), (FCT) (Art/Lum+Pri), (FPT) (Clo+Pri), (FPT) (Art/Lum+Pri), y (RCPA) (Clo+Pri) y (RCPA) (Art/Lum+Pri), tal como fue definido.
Fueron evaluados los posibles factores de riesgo para observar su grado de asociación, calculando OR, su intervalo de confianza (IC 95%), además de la significancia estadística (X²>= 3,84, valor de p <0,05%), de las variables (edad, terapia antimalárica anterior, densidad parasitaria inicial, etc.) buscando su asociación con la probabilidad de fracasos terapéuticos y tiempo hasta el fracaso terapéutico.
Al terminar el estudio (Día 28), o antes, si los pacientes experimentaron fracaso terapéutico, el personal del estudio les informó verbalmente sobre el resultado de su tratamiento.
El trabajo de investigación cumplió con las normas establecidas según con la declaración de Helsinski, enmendada en 1983. Se solicitó el consentimiento informado a los pacientes, previa explicación del estudio, catalogándolo como de riesgo mínimo. Los medicamentos administrados forman parte de las pautas terapéuticas utilizados por el Programa antimalárico Nacional del MPPS.
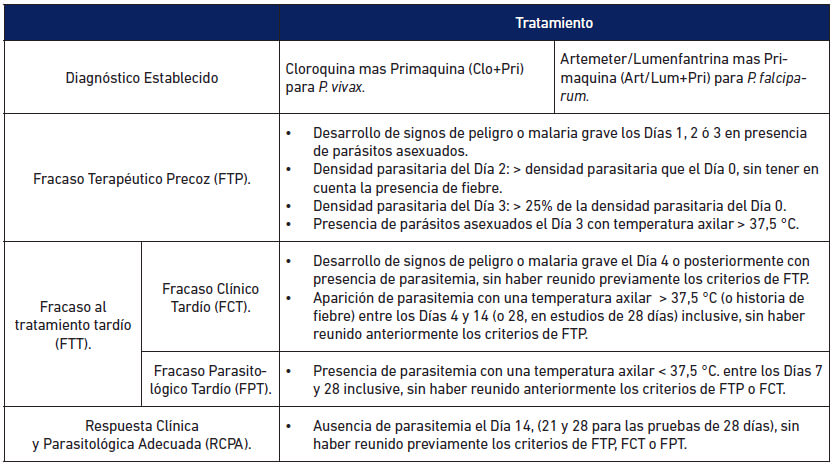
La evaluación de resultados se realizó según el Protocolo genérico para estudios in vivo de eficacia de los medicamentos antimaláricos en las Américas (OPS 2017), y la evaluación de eficacia, según los resultados clínicos y parasitológicos de la manera siguiente: (Tabla 1).
Con el objetivo de evaluar la eficacia terapéutica in vivo, de los medicamentos antimaláricos de primera línea en Venezuela, fueron estudiadas 80 personas: 40 diagnosticadas positivas a Plasmodium vivax, a las cuales se les aplicó tratamiento con Cloroquina + Primaquina durante 14 días, y 40 infectadas a Plasmodium falciparum, a quienes se les administró tratamiento con Artemeter/Lumefantrina + Primaquina, durante 4 días.
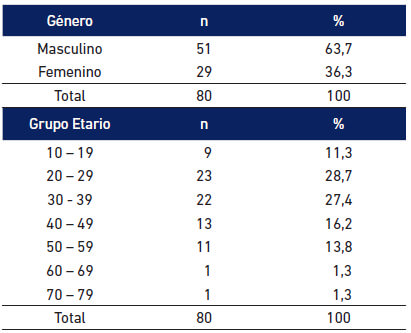
Del total de participantes, 51(63,8%) fueron del sexo masculino y 29(36,3%) del femenino. Las edades estuvieron comprendidas entre los 11 y 76 años, con un promedio de 34 años. El grupo etario con mayor número de participantes fue el de 20 a 29 años (28,8%). Entre los 20 y 39 años se concentraron 56,1% de los pacientes (Tabla 2).
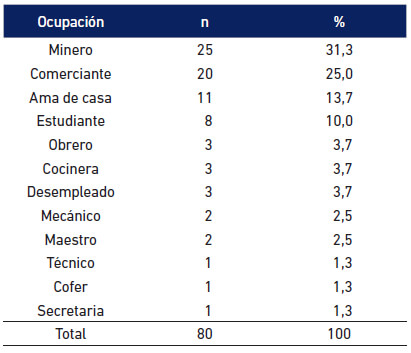
En las áreas mineras del estado Bolívar se puede encontrar toda clase de ocupaciones entre las personas que allí conviven, y cada una es libre de laborar en lo que esté capacitado o desee desarrollar. De allí, que los infectados presentan diversidad de trabajos u ocupaciones. Los mineros se ubicaron en el primer lugar entre los infectados (31,3%), seguidos de los comerciantes con 25% (Tabla 3).
Fue evidente la alta Incidencia entre los pacientes estudiados. Sólo 9(16,1%) de ellos, eran primoinfección. En promedio, los participantes fueron diagnosticados con malaria 2 veces el último año, presentándose pacientes quienes refirieron hasta 20 y 30 episodios de la enfermedad en su vida.
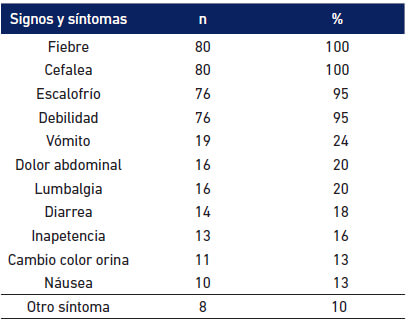
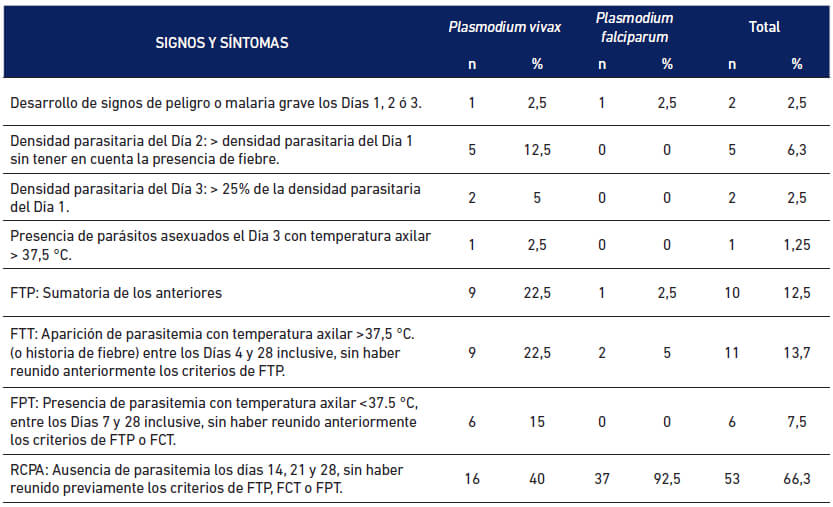
La fiebre, la cefalea y el escalofrío, fueron los signos y síntomas con mayor presencia entre los infectados. Todos presentaron las dos primeras manifestaciones y 95% la tercera (Tabla 4).
El día del diagnóstico inicial de malaria de los pacientes en estudio o día “cero”, se observaron las siguientes características parasitológicas: 52(65%) presentaron parásitos asexuados y 43(53,8%) tenían gametocitos.
El día “uno”, después de recibir la primera dosis del tratamiento, 10 pacientes se encontraron positivos (9 a P. vivax y 1 a P. falciparum), 50% de ellos con 10 a 50 parásitos asexuados y todos con presencia de gametocitos.
El día “dos”, hubo 8 positivos a P. vivax, de los cuales 5(62,5%) presentaban parásitos asexuados, y todos portadores de gametocitos.
El día “tres”, fueron diagnosticados 3 pacientes con infección a P. vivax, todos con gametocitos y 2(66,7%) presentaron parásitos asexuados, registrando 7 pacientes con Fracaso Terapéutico Precoz (FTP) (Tabla 5).
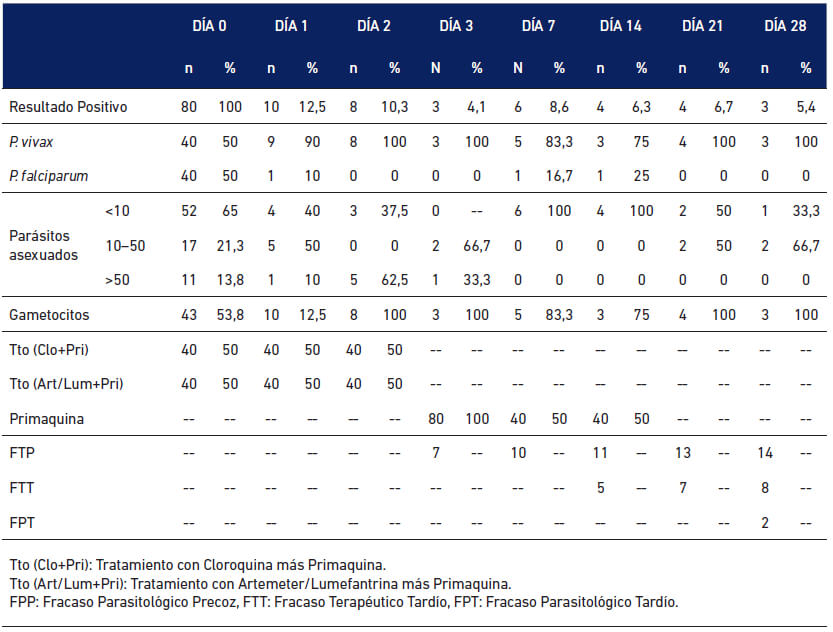
Para el día “siete” del tratamiento, 6(8,6%) de los pacientes resultaron positivos (5 a P. vivax y 1 a
P. falciparum
. 5 presentaron gametocitos y los 6 tenían menos de 10 parásitos asexuados. En total, para el día “siete”, 10 pacientes presentaban FTP (Tabla 5).El día “catorce”, 4 pacientes estaban positivos a Plasmodium (3 a P. vivax y 1 a P. falciparum), con menos de 10 parásitos asexuados y 3 de ellos con gametocitos. Para este día 11 pacientes presentaban FTP y 5 con Fracaso Tardío al Tratamiento (FTT) (Tabla 5).
Veintiún días después de iniciado el tratamiento, otros 4 pacientes resultaron positivos a P. vivax, 2 con menos de 10 parásitos asexuados y dos entre 10 y 50 parásitos. Todos presentaron gametocitos. 13 pacientes fueron declarados FTP y 7 FTT (Tabla 5).
En el último día de control o día “veintiocho”, fueron 3 los pacientes diagnosticados con P. vivax, 2(66,7%) con parásitos asexuados y todos con gametocitos. Para la fecha, había 14 pacientes con FTP, 8 con FTT y 2 con Fracaso Parasitológico Tardío (FPT) (Tabla 5).
Por otra parte, la Respuesta Clínica y Parasitológica Adecuada (RCPA), de los medicamentos al final de la evaluación fue de 66,3%, siendo 40% para Cloroquina + Primaquina en el caso de P. vivax, y 92,5% para Artemeter + Lumefantrina para P. falciparum (Tabla 6).
Dieciséis pacientes con infección a P. vivax tuvieron Respuesta Clínica y Parasitológica Adecuada al tratamiento: 11 hombres y 5 mujeres entre 17 y 50 años de edad, 9 habían presentado malaria anteriormente, 35,7% de los comerciantes y 36,4% de los mineros. Entre los infectados con P. falciparum sólo 3 pacientes no registraron Respuesta Clínica y Parasitológica Adecuada al tratamiento: 2 mujeres, 1 hombre, entre 31 y 55 años, 1 minero, dos amas de casa (Tabla 6).
El fracaso terapéutico precoz (FTP) o desarrollo de signos de peligro o malaria grave los tres primeros días del tratamiento, alcanzó 22,5% para Cloroquina + Primaquina, y 2,5% para Artemeter + Lumefantrina (Tabla 5). Fue observado fracaso tardío al tratamiento (FTT) o aparición de parasitemia con temperatura axilar >37,5 °C. (historia de fiebre), entre los Días 4 y 28 inclusive sin haber reunido anteriormente los criterios de FTP. Para Cloroquina + Primaquina 22,5%, y para Artemeter + Lumefantrina, 5% (Tabla 6).
El fracaso parasitológico tardío (FPT), o presencia de parasitemia con temperatura axilar <37,5 °C, entre los días 7 y 28 inclusive, sin haber reunido anteriormente los criterios de FTP o FCT, se evidenció en 15% de los pacientes tratados con Cloroquina + Primaquina (Tabla 6).
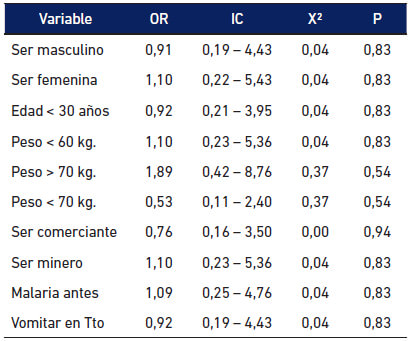
También, en búsqueda de factores asociados a Respuesta Clínica y Parasitológica Adecuada, fueron analizadas las variables demográficas y los signos y síntomas de los pacientes. Diez variables presentaron asociación, 5 predisponentes y 5 protectoras, pero ninguna evidenció significancia estadística. Poseer un peso mayor a 70 kg, tiene 89% más probabilidad de curarse de la infección que los de peso menor, sin significancia estadística (Tabla 7).
La malaria ha afectado desde su descubrimiento a grandes masas poblacionales en el mundo, causando innumerables defunciones. En los últimos 15 años, en Venezuela la enfermedad ha mostrado un notable incremento en su incidencia y mortalidad debido entre otras causas, a la emergencia económica y social del país, que propicia la ocupación laboral de gran cantidad de personas en áreas endémicas de la enfermedad.
Aunque el problema de la resistencia a las drogas está presente en todas las zonas endémicas de paludismo en el mundo, las áreas reconocidas actualmente como más seriamente afectadas, son la península de Indochina y la región del Amazonas en Suramérica (WHO, 2005) (Snow, 2005).
Según estudios, varios mecanismos han sido valorados para explicar los cambios ocurridos en la sensibilidad las drogas antipalúdicas: adaptaciones fisiológicas debidas a cambios no genéticos, selección de las células droga-resistentes previamente existentes en una población mixta bajo la acción de la droga (selección de mutantes), mutación espontánea y mutación de genes extranucleares (OPS, 2006).
En nuestro caso, la Respuesta Clínica y Parasitológica Adecuada de 92,5% del Plasmodium falciparum a la combinación Altemeter/lumefantrina, se puede considerar alta, sin embargo, confirma cierta falla terapéutica ya reseñada.
De acuerdo a las experiencia de Rojas (2010), en Colombia desde el año 2006 hasta la fecha, se está utilizando la combinación terapéutica Artemeter/ Lumefantrina en áreas con alta transmisión de malaria, con adecuada respuesta terapéutica y pocas fallas al tratamiento. En el departamento del Chocó, Colombia, el resultado mostró después del seguimiento estándar de 28 días, con el tratamiento Artemeter/ Lumefantrina una tasa de curación ajustada por reacción de cadena de polimerasa (PCR) de 99% (IC95% 97-99,9), consistente con la mayoría de estudios realizados en la región amazónica desde 2003, según datos de la Red Amazónica de Vigilancia de la Resistencia a Antimaláricos.
En dichos estudios, fue evaluada la eficacia de la combinación Artemeter/Lumefantrina con resultados de fallas terapéuticas inferiores a 5%: en Brasil (0%), Ecuador (0%), Venezuela (0%), Guyana (1,7%) y en Suriname se observan los porcentajes de falla terapéutica más elevados de la región entre 1,9% y 4,5%, la mayoría de fallas tardías, lo cual no se traduce necesariamente en resistencia a la combinación, sin descartar problemas de absorción de la Lumefantrina, o la posibilidad de reinfección (OPS, 2005).
Por su parte, Ferreira et al. (2008), reportaron una disminución significativa de la sensibilidad in vitro al Artemeter del P. falciparum en aislamientos de la Guyana Francesa en la frontera con Brasil, sin embargo, la misma no fue acompañada de un incremento en las fallas terapéuticas.
En Tanzania y Burundi, donde se evaluó la eficacia de Artemeter/Lumefantrine (AL) vs Artesunato + Amodiaquina (AQ+AS), al día 28 hubo menor número de fallas con AL en Tanzania (AL= 29%, AQ+AS=51%; RR 0,56, 95% CI 0,48 – 0,66). El día 14, hubo pocas fallas parasitológicas tanto en Tanzania (AL= 1,3%, AQ+AS 13%), como en Burundi (AL=0,7%, AQ+AS= 4,6%; RR 0,15, 95% IC 0,02-1,21). Igualmente, la carga de gametocitos para el día 14 fue significativamente baja en ambos estudios (Martensson et al. 2005).
También, en una revisión sistemática de Cochrane, de 50 estudios evaluando la eficacia de las cinco CTDA, de primera línea más utilizadas en el mundo, se observaron algunos estudios donde reportan fallas terapéuticas superiores a 10% en todas las combinaciones (Sinclair et al. 2009).
En Camboya, fue realizado un estudio con 190 pacientes de los cuales 55 fueron tratados con Artemeter/Lumefantrina, en los que se encontró una tasa de curación de 71,1%. Encontraron que las fallas terapéuticas para este tratamiento están relacionadas con las concentraciones plasmáticas de Lumefantrina, las cuales se garantizan, siempre y cuando, el medicamento se suministre con suplemento alimenticio graso (Denis et al. 2006).
Un estudio multicéntrico realizado en África, evidenció que la respuesta clínica y parasitológica adecuada fue de 95,5% para Artemeter/Lumefantrina, mientras que en Nigeria se observaron tasas de curación para Artemeter/Lumefantrina de 100% (ρ = 0.66), datos corregidos con PCR (Falade et al. 2008).
Por otra parte, la alta proporción de pacientes con gametocitos el día “cero” (53,8%), observada en nuestro estudio, especialmente en infecciones a P. vivax, evidencia dificultad para el acceso a los servicios de salud, sea por demora al acudir a un centro diagnóstico, o su indisponibilidad, lo cual evita un diagnóstico precoz y un tratamiento oportuno de los pacientes con malaria. Luego, la presencia de los mismos hasta el día 28, reflejaría la problemática existente con los tratamientos.
En Colombia, 30% de los pacientes tratados con Artemeter/Lumefantrina y 35% del grupo de Amodiaquina + Artesunato tenían gametocitos al día 0, sin embargo, en ninguno de los tratamientos se observaron gametocitos después del segundo día (Rojas, 2010).
En Burundi se reportaron gametocitos al día 7; encontrándose menor cantidad en el grupo Artemeter/ Lumefantrina con un RR 0,68 (IC95% 0,33-1,41) (Ndayiragije, 2004).
Según lo descrito por Sutherland et al. (2005), las combinaciones terapéuticas con derivados de Artemisinina, han logrado una disminución en los gametocitos de forma tan significativa, que se ha logrado una disminución en la transmisión del parásito al mosquito y podrían minimizar la transmisión de parásitos resistentes.
Para el desarrollo de resistencia a la Artemisinina, es importante la eficacia del otro medicamento que hace parte de la combinación y otros factores que aún no están siendo estudiados. En la Guyana Francesa, Jambou et al. (2005), también reportaron una disminución de la actividad in vitro del Artemeter en la frontera con Brasil, esto debido a una mutación en el sitio blanco de acción de las Artemisininas, lo cual generó gran preocupación en la región y la necesidad de un monitoreo continuo de la eficacia de las combinaciones, sin observar a la fecha un incremento en las fallas terapéuticas.
Sin embargo, desde el año 2009, existe la preocupación creciente por la aparición de resistencia a los derivados de la Artemisinina en la frontera de Tailandia y Camboya, donde históricamente ha aparecido la resistencia a los medicamentos antimaláricos. Esta resistencia se traduce en prolongación en el tiempo de eliminación de los parásitos, lo cual reduce la respuesta terapéutica (Dondorp et al. 2009).
En cuanto al tratamiento combinado con Cloroquina + Primaquina, el mismo suele ser el indicado para la cura radical de las infecciones por P. vivax. La Cloroquina actúa sobre las formas sanguíneas asexuales y las formas sexuales inmaduras del parásito, mientras que la Primaquina posee actividad gametocida y esquizonticida tisular (Bergonzoli et al. 2000).
No obstante, el tratamiento con Cloroquina + Primaquina para las infecciones a P. vivax, produjo una Respuesta Clínica y Parasitológica Adecuada de sólo 40%, considerada una eficacia “muy baja” para un área de tan alta endemicidad, más si la comparamos con el estudio de Krudsood et al. (2007), quienes reportaron que la Cloroquina sigue siendo el fármaco de elección para el tratamiento del Plasmodium vivax en Tailandia, al reportar 100% de curación en 51 pacientes tratados, muy distante del porcentaje alcanzado en nuestro estudio.
De acuerdo a lo observado, el principal fallo en la administración de la combinación de Cloroquina + Primaquina se presentó por el Fracaso Terapéutico Tardío, donde la parasitemia reapareció con una temperatura axilar mayor de 37,5 °C, entre los días 4 y 28. En muy pocos casos se desarrollaron signos de peligro con la administración de la combinación Cloroquina + Primaquina en los días 1, 2 o 3.
En Bolivia, una evaluación in vivo de la eficacia de la Cloroquina para el tratamiento de la malaria por Plasmodium vivax, en el Departamento de Tarija, incluyó 61 pacientes entre 5 y 59 años de edad. Todos recibieron una dosis total de Cloroquina de 25 mg/Kg en 3 días. De acuerdo al protocolo estandarizado de la OPS/OMS, los pacientes fueron seguidos por 28 días, completando el seguimiento de 60 pacientes. No se presentaron recurrencias de la parasitemia o manifestaciones clínicas después del tercer día de tratamiento, lo cual mostró 100% de sensibilidad de Plasmodium vivax al medicamento (Martínez et al. 2009).
También en Bolivia, fue evaluada la eficacia terapéutica de la Cloroquina como tratamiento de malaria no complicada por P. vivax en Riberalta, Guayaramerín y Yacuiba, en pacientes entre 5 y 59 años. Se suministró Cloroquina (25 mg/kg en tres días), y se hizo seguimiento por 28 días, midiendo los niveles de Cloroquina en sangre y desetilcloroquina, el día dos y el día de registro de reaparición de parasitemia. Se estudiaron 223 pacientes. Las medias de densidad parasitaria (formas asexuadas) del día 0 en Riberalta fueron de 6.147, en Guayaramerín, 4.251, y en Yacuiba, 5.214 parásitos/μl de sangre. Mientras en Yacuiba no se presentaron fracasos terapéuticos, en Riberalta ocurrieron en 6,2% y en Guayaramerín 10% (Añez et al. 2012).
En otro orden de ideas, algunas de las variables demográficas, los signos y los síntomas, presentaron asociación con la Respuesta Clínica y Parasitológica Adecuada, sin significancia estadística, mientras que en un estudio realizado en Costa Rica, no se encontró ninguna variable (edad, peso, talla, sexo, consumo de tabaco y alcohol, escolaridad y parasitemia), que afectara la eficacia, lo que permitió concluir que los posibles factores de confusión estuvieron homogéneamente distribuidos entre los diferentes grupos (Bergonzoli et al. 2000).
Finalmente, el valor de la Respuesta Clínica y Parasitológica Adecuada para P. falciparum (92,5%), de la combinación Artemeter/ Lumefantrina podría ser aceptable, mientras que la respuesta de la Cloroquina + Primaquina a P. vivax (40%), hace pensar en la necesidad de buscar una combinación sustituta, con mayor eficacia, en razón a la recomendación de las guías recientes de tratamiento antimalárico, las cuales recomiendan un cambio en la política de tratamiento cuando el porcentaje de falla terapéutica sea superior a 10%.
Dado que la eficacia de un tratamiento depende de diversos factores tanto intrínsecos como extrínsecos (disponibilidad del tratamiento, adherencia, especificidad del medicamento, carga parasitaria, farmacocinética, seguridad y tolerabilidad del medicamento), se hace necesario realizar un estudio que establezca nuevas asociaciones con dichas variables y la medición de concentraciones hemáticas y urinarias de los medicamentos, e implantar un sistema de monitoreo permanente de los medicamentos utilizados.
También, es necesario un control riguroso de los medicamentos en áreas maláricas, evitando su comercio, y la aplicación indebida de dosis, como también, el uso de medicamentos traídos del exterior, además de mejorar el sistema de vigilancia epidemiológica, en el sentido que el mismo registre e identifique los pacientes cada vez que soliciten un examen de gota gruesa, y reciban tratamiento, para evitar la repetición de pacientes tratados en distintos centros antimaláricos.
Por supuesto, es imprescindible, que el programa antimalárico del MPPS, esté en consonancia con la Estrategia técnica mundial contra la malaria 2016-2030, elaborada por la OMS el año 2015, con el propósito de ayudar a los países a reducir el sufrimiento humano causado por la más mortal de las enfermedades transmitidas por mosquitos en el mundo.