La cardiotoxicidad crónica por adriamicina, constituye una de las principales causas de morbilidad y mortalidad, asociada a la administración de este agente antineoplásico, especialmente en niños sobrevivientes al cáncer. A fin de evaluar el efecto que sobre el desarrollo ejerce la adriamicina, en este trabajo, se estudia las alteraciones histológicas y del perfil proteico de la cardiotoxicidad crónica inducida por adriamicina, administrada a ratas al final del período de lactancia. Ratas macho Sprague-Dawley, fueron distribuidas al azar (n=6) en grupos control (CON) y adriamicina (ADR). La adriamicina fue administrada (6 mg/kg p.c.) en tres subdosis (2 mg/kg p.cc/u en NaCl a 0,9%, 0.1mLi.v.). Al grupo CON se le administró solución fisiológica (NaCl 0,9%, i.v. 0,1 mL). Ambos, cada tres días. A las seis semanas post-tratamiento, las ratas fueron sacrificadas. La pared ventricular izquierda, fue procesada para análisis histológico y electroforesis en dos dimensiones (EF-2D). Los resultados mostraron una respuesta diferencial entre el grupo ADR, respecto al grupo CON. A nivel histológico, en el grupo ADR, se evidenció un incremento del tejido fibroso. En el perfil proteico del grupo ADR, se observó una variación en la cantidad y abundancia relativa de los puntos proteicos. La presencia de tejido fibroso en el grupo ADR, es un indicio de daño cardíaco inducido por adriamicina. Esto es consistente con la alteración en el perfil proteico del grupo ADR, en el que se evidencia la inhibición total o parcial de algunas proteínas, así como la sobre expresión de otras. La adriamicina genera fibrosis y altera el perfil de expresión de proteínas del miocardio a las seis semanas post-tratamiento.
Palabras clave: adriamicina; cardiotoxicidad crónica; perfil proteico; pared ventricular izquierda; fibrosis cardíaca
Chronic cardiotoxicity induced by adriamycin, is one of the main causes of morbidity and mortality, associated with the administration of this antineoplastic agent, especially in children surviving cancer. In order to evaluate the effect of adriamycin on development, in this work, the histological and protein profile alterations of the chronic cardiotoxicity induced by adriamycin, administered to rats at the end of the lactation period. Male Sprague-Dawley rats (62g p.c.), were randomly distributed (n=6) incontrol (CON) y adriamycin(ADR)groups. Adriamycin was administered (6 mg / kg p.c.) in three sub-doses (2 mg / kg p.c each in 0.9% NaCl, 0.1mL i.v.). The CON group was administered physiological solution (NaCl 0.9%, i.v. 0.1 mL). Both, every three days. At six weeks post-treatment, the rats were sacrificed. Left ventricular wall was processed for histological and electrophoresis in two dimensions (EF-2D) analysis. Differential response between the ADR and CON groups, were evidenced. Histologically, an increase in fibrous tissue in the ADR group, was observed. In protein profile of the ADR group, a variation in the amount and relative abundance of the protein points, was observed. Fibrous tissue in the ADR group seems to be a consequence of the damage induced by adriamycin. This is consistent with the alteration in the protein profile of the ADR group, in which the total or partial inhibition of some proteins is evidenced, as well as the overexpression of others. Adriamycin generates fibrosis and alters the expression proteins profile of myocardial at six weeks post-treatment.
Key words: adriamycin; chronic cardiotoxicity; protein profile; left ventricular wall; cardiac fibrosis.
La adriamicina se encuentra entre los primeros antibióticos de la familia de las antracíclinas empleados con propósitos clínicos en la quimioterapia del cáncer (Octavia et al. col., 2012; Torres et al. 2012). Esta posee el mayor espectro de acción efectiva en el tratamiento quimioterapeútico de enfermedades neoplásicas (Octavia et al. 2012; Torres et al. 2012). No obstante, la administración crónica de la adriamicina ha estado asociada con el desarrollo de una cardiotoxicidad dosis-dependiente e irreversible, que ha limitado su empleo (Rochetteet al. 2015). Esta cardiotoxicidad, constituye una de las principales causas de la morbilidad y la mortalidad asociada a la administración de este agente quimioterapèutico (Pasca et al. 2000; Torres et al. 2012), siendo la población infantil la más afectada ya que pueden padecer esta enfermedad, varios meses o años después de culminada la terapia con adriamicina (Trachtenberget al. 2011). En pacientes pediátricos, este tipo de cardiomiopatía ha estado vinculada con alteraciones en el grosor de la pared ventricular izquierda, la contractibilidad y el crecimiento miocárdico, las cuales se expresan después 6 a 7 años de culminado el tratamiento antineoplásico con adriamicina (Lipshultzet al. 2010) y en algunos casos después de los 15 años (Hershmanet al. 2008). El carácter irremplazable de las adriamicina debido a su gran potencialidad antineoplásica, frente a la importancia clínica de la cardiotoxicidad inducida por ella, especialmente en la población infantil, obliga a seguir ampliando y profundizando la investigación vinculada a su mecanismo de acción, a fin de encontrar un balance entre el riesgo de cardiotoxicidad y los beneficios de la eficacia antineoplásica con adriamicina. Más aún, si se considera que la quimioterapia sigue siendo en la actualidad, la solución antineoplásica de un número elevado de individuos. Con el fin de evaluar el efecto que sobre el desarrollo que ejerce la adriamicina, en este trabajo se describen, las alteraciones histológicas y proteícas de la cardiotoxicidad crónica inducida por adriamicina en ratas de la cepa Sprague Dawley, a las seis semanas post-tratamiento con adriamicina. Esta última, administrada, luego de veintiocho días de nacidas, correspondiendo con el final del período de lactancia. De esta forma, a las seis semanas post-tratamiento, que correspondería a 70 días de nacida, las mismas estarían entrando en la etapa de adulto joven (Sepgunta, 2013).
LeicaBiosystems Europa Ltd. (Peterborough, UK): Paraplast ®. Riedel de Haën (Seelze, Alemania): Xilol, etanol. Sigma-Aldrich Inc. (Missouri, U.S.A): Ácido acético. Merck Millipore (Darmstadt, Alemania): Kit de tinción de Masson-Goldner. Bio-Rad Laboratories, Inc. (Hercules, CA USA): Acrilamida; Bradford ProteinAssay; TRIS base [(tris(hidroximetil)aminometano]; persulfato de amonio (PSA); glicina; agarosa con azul de bromofenol; tris(2-carboxyethyl) phosphine (TCEP); tiras de gradiente de pH inmovilizado (IPG) 7 cm, pH 5-8; aceite mineral; trozos de papel de filtro (ElectrodeWicks); glicerol; iodoacetamida (IOA); Coomassie G-250; urea; anfolitos (Bio-Lyte 3/10 Ampholyte). PromegaCorporation (Wisconsin, USA): Dithiothreitol (DTT), dodecil sulfato de sodio (SDS), bis-acrilamida. Merck KGaA (Darmstadt, Germany): 3-[(3-cholamidopropyl)dimethylammonio]-1-propanesulfonate (CHAPS). Sigma-Aldrich Inc. (St. Louis, MO, U.S.A): Tetramethylethylenediamine (TEMED); NaCl, KCL, Na2HPO4, KH2PO4; albúmina sérica de bovino (BSA); cóctel de inhibidores de proteasa (SigmaFASTäProteaseInhibitor Tablet), thiourea, azul de bromofenol, agarosa. Invitrogen Corporation (Carlsbad, CA, U.S.A): estándar de peso molecular (BenchMarkProteinLadder). Riedel de Haën (Seelze, Alemania): metanol, etanol y ácido acético. Thomas Scientific (Swedesboro, NJ, U.S.A.): homogeneizador Potter-Elvejheim.
Ratas macho Sprague-Dawley de 21 día de nacidas (~ 62 g, n=6), fueron adquiridas en el bioterio del Instituto de Medicina Experimental, de la Universidad Central de Venezuela (UCV). Fueron mantenidos en el cuarto de manejo y cuidado de animales de la Sección de Biología Celular del Instituto de Medicina Tropical (IMT) de la UCV, de acuerdo a la Norma Oficial Mexicana (NOM-062-ZOO, 1999). A las ratas se les permitió libre acceso a la dieta estándar con Ratarina de Protinal ®, y agua filtrada ad libitum.
Luego de la primera semana de adaptación, las ratas fueron distribuidas al azar en dos grupos: CONTROL (CON) y ADRIAMICINA (ADR). Al grupo CON se le administró 0,1 mL de solución salina (0,9% NaCl) por la vena caudal y al grupo ADR se le administró 6 mg/kg p.c. de adriamicina, dividida en tres subdosis de 2 mg/kg p.c. en un volumen estándar de 0,1 ml de solución salina (0,9% NaCl). En ambos grupos, cada tres días. El peso corporal promedio de las ratas fue monitoreado una vez por semana. Los cambios físicos y conductuales, fueron monitoreados diariamente. Luego de 6 semanas post-tratamiento, las ratas fueron sacrificadas por dislocación cervical. El corazón fue colectado y pesado. Se tomaron muestras de la pared ventricular (PVI), para el análisis histológico y obtención de los perfiles proteicos. La longitud corporal, fue obtenida post-mortem.
Porciones de la PVI, previamente perfundidas con amortiguador fosfato salino (PBS: phosphatebufferedsaline, NaCl, KCL, Na2HPO4, KH2PO4) a pH 7.4; fueron deshidratadas en una batería de etanol (50 % y 80% por 45 min., 90% y 100% dos cambios por 1 h) y aclaradas con Xilol al 100 % (2 x 1h y 1 ½ h, respectivamente); para su posterior inclusión en bloques de parafina sintética (Paraplast ®). Para realizar la caracterización histológica de la PVI, se realizaron cortes de 4 micras de las muestras incluidas, con el microtomo de rotación (Reichert-Jung: Heidelberg, Germany); y se procedió a colorearlas con el método de Tricrómico de Manson (Blandeiner et al., 2004) de acuerdo a las especificaciones de la casa comercial del Kit de tinción de Masson-Goldner. Los registros digitales de las imágenes se realizaron en un microscopio invertido Microscopio invertido IX71 (Olympus Corporation: Pensilvania, U.S.A.) mediante el programa SoftImagingSystemCell software v.8.
Las muestras de la PVI fueron perfundidas (30 mMNaCL; 4 mM KCL; 2,5 mM MgCl2; Glucosa 18 mM, Tris 4mM), congeladas con N2 líquido para pulverizarla y homogeneizadas con 400 μL de amortiguador de lisis (Urea 9,5 M: CHAPS 2%; DTT 1%, anfolitos 0,8%) en presencia de inhibidores de proteasas. El homogenato fue centrifugado a 16.000 g por 10 minutos (4 °C) para remover grandes fracciones celulares. El sobrenadante fue centrifugado 21.000 g por 25 minutos (4 °C). El segundo sobrenadante fue almacenado a -70ºC. La determinación de la concentración de las proteínas se empleó un ensayo modificado del método de Bradford (Bradford, 1976; Thongboonkerdet al. 2006). Las densidades ópticas se determinaron en el Spectrophotometer Surrise empleando el programa Magellan Software v 6.6 (TECAN Austria GmbH: Salzburg, Austria).
Las tiras de IPG (7 cm, pH continuo de 5-8), fueron hidratadas, con 150 μg de proteínas previamente solubilizadas en un amortiguador de hidratación (Urea 8 M; Tiourea 2 M; CHAPS 4%; DTT 2 mM, anfolitos 0,2% y azul de bromofenol), en un volumen de 130 μL. Luego de 15 minutos de hidratación pasiva (0V a 25 °C), se procedió a realizar una hidratación activa por 12 h (50V a 20°C) en el Protean IEF CellSystem (BIO-RAD Laboratories, Inc. (Hercules, CA USA). El isoelectroenfoque (IEF) se realizó por triplicado para cada una de la muestras, a 50 μA por tira de IPG y una temperatura de 20 °C. El IEF Las condiciones del IEF fueron 250V por 0,5 h (lineal), 500 V por 1 h (lineal), 1000 V por 1 h (lineal), 4000 V por 1 h (lineal), 4000 V por 10.000 V: h (rápido), 500 V por 10 h (rápido). Lo anterior a 20 °C. Luego de la primera dimensión, las proteínas en las tiras de IPG fueron equilibradas con 5 mM del agente reductor, DTT; y posteriormente alquiladas con 2,5 % de IOA, empleando un amortiguador de equilibrio base (6M de Urea, 2% de SDS, 20% de Glicerol y 375 mM de Tris a pH 8.8) durante 15 minutos a 25°C. Finalmente, la separación de las proteínas en la segunda dimensión se realizó por SDS-PAGE (Laemmli, 1970), empleando geles de poliacrilamida al 12,5 % y 1,5 mm de grosor, 3º mA por gel a 25°C. Para ello se lavaron las tiras de IPG en un amortiguador de (Tris-Base 33 mM, glicina 256 mM a pH 8.3, SDS al 0.1%) y se fijaron sobre el gel de poliacrilamida con agarosa fundida al 0,5 % con trazas de azul de bromofenol. Luego de lavar los geles con agua Milli-Q por 10 minutos, las proteínas fueron fijadas (25% alcohol isopropílico, 10% ácido acético) por 15 minutos y coloreadas con Blue Silver (11, 76 % ácido fosfórico, 10% sulfato de amonio, 20 % metanol, 0,12 % de Coomassie G-250), un colorante que detecta de 5 a 10 ng de proteínas (Candianoet al.2004). Luego de 24 h, se procedió a decolorar en agua Milli-Q hasta alcanzar el contraste deseado, y se almacenaron en una solución al 1% de ácido acético.
Los geles fueron registrados y editados en el Molecular Imager® GS-800™ CalibratedDensitometer empleando el programa QuantityOne® 1D Analysis Software (Bio-Rad Laboratories, Inc.: Hercules, CA USA). El análisis de las imágenes fue realizado con el programa PDQuestTMAdvanced 2-D Analysis Software (Bio-Rad Laboratories, Inc.: Hercules, CA USA). La densidad óptica (DO: el área de punto proteico multiplicado por la densidad del pixel) de los puntos proteicos (p.p.), será referida en el texto como abundancia relativa. La DO de cada p.p., fue normalizada con la densidad total del gel, a fin de garantizar que las variaciones en el tamaño y la intensidad de cada punto proteico entre los geles, se debiera únicamente al tratamiento y no por error experimental. Luego se evaluó la presencia, ausencia y variaciones diferenciales en la DO entre los p.p. del grupo ADR y el grupo CON.
Las diferencias entre el peso y longitud corporal; y peso del corazón, del grupo ADR respecto al grupo CON, fueron evaluadas estadísticamente, mediante una prueba de t-Students, previa verificación del cumplimiento de los supuestos de homogeneidad de varianza, independencia de las muestras y normalidad de la población experimental (Daniel, 2002), con un intervalo de confianza del 95% (p < 0.05).
Las diferencias estadísticamente significativas en las abundancias relativas de los puntos proteicos entre el grupo ADR y el grupo CON, fueron identificadas automáticamente por el programa PDQuestTMAdvanced 2-D Analysis Software, mediante la prueba t-Student, con un intervalo de confianza del 95% (p < 0.05). De estas últimas, solo se consideraron en este estudio, aquellos puntos proteicos cuya abundancia relativa en el grupo ADR, presentara una variación de ±1,5 veces respecto al grupo CON. Aquellos puntos proteicos en el grupo ADR con una diferencia en su abundancia relativa superior a 1,5 veces la observada en el grupo CON y estadísticamente significativos, fueron considerados como sobreexpresión o disminución de la expresión de esas proteínas. El término de sobreexpresión se refiere en este trabajo, a un incremento en la cantidad de proteínas sobre el gel e implica tanto la síntesis de proteínas, como la presencia de fragmentos derivados de proteínas existentes por procesos proteolíticos. De ser menor a 1,5 veces, se considera inhibición de su expresión.
Esta investigación se realizó cumpliendo con las normas establecidas en la NORMA Oficial Mexicana NOM-062-ZOO-1999 en cuanto a las especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio y por la guía para el cuidado y uso de los animales de laboratorio publicada por el Institute of Laboratory Animal Resources de Estados Unidos de América. De igual forma cuenta con el aval del Comité de Bioética del Instituto de Medicina en el marco del proyecto Individual del CDCH PI-09-8187-2011-I.
La caracterización del modelo animal contempló una descripción de los cambios morfológicos externos que abarcó signos físicos, peso promedio corporal y longitud promedio corporal.
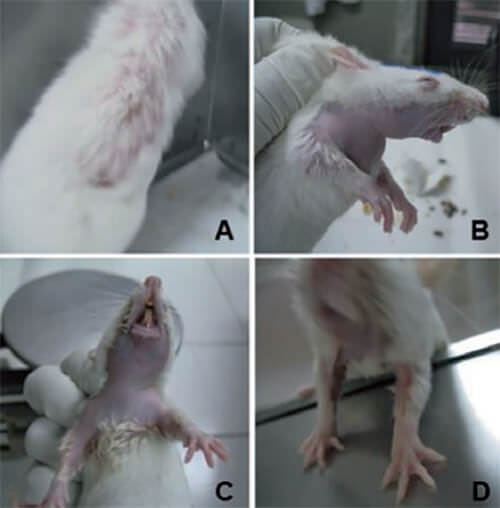
Las ratas pertenecientes al grupo CON, no presentaron alteraciones en sus características morfológicas distintas a lo descrito para cada una de las etapas de crecimiento durante las seis semanas post-tratamiento. A diferencia de estas, las ratas pertenecientes al grupo ADR, presentaron alteraciones no solo en sus características morfológicas, sino conductuales.
En la segunda y tercera semana post-tratamiento, el 100% de los individuos del grupo ADR, presentó algún signo de alopecia. En el 67 % de los individuos, esta alopecia fue parcial, apenas evidente en áreas como el lomo, laterales del cuerpo y mandíbula inferior (A). En los individuos restantes, la alopecia fue total en mandíbula inferior, abarcando pecho hasta el interior de los miembros anteriores (B y C); y en abdomen, abarcando el interior de los miembros posteriores (D). Adicionalmente a la alopecia, también se observó parpados adheridos productos de la resequedad lacrimal en aproximadamente el 16 % de losindividuos; y pérdida de uno o de los dos incisivos inferiores en el 33% de los individuos del grupo ADR, luego de una inflamación sostenida en sus encías. Estos signos fueron gradualmente desapareciendo desde mediados de la tercera semana post-tratamiento hasta inicios de la quinta.
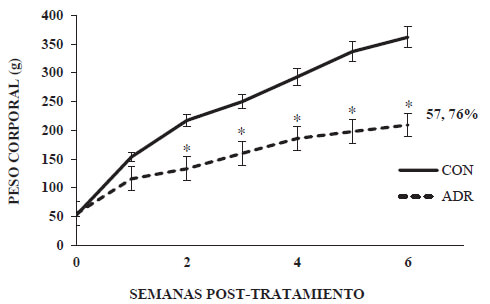
El peso corporal promedio de las ratas SpragueDawley de todos los grupos experimentales en la semana cero fue de 60 ± 3 gramos. Una vez iniciado el tratamiento, se observó un incremento diferencial y progresivo en el promedio de la ganancia de peso corporal de ambos grupos experimentales hasta la cuarta semana. El grupo CON, presentó un promedio de ganancia de peso corporal significativamente mayor respecto al grupo ADR, a partir de la segunda semana. A la sexta semana, el grupo ADR presentó una disminución en su promedio de ganancia de peso corporal del 57, 76 %, respecto al grupo CON.
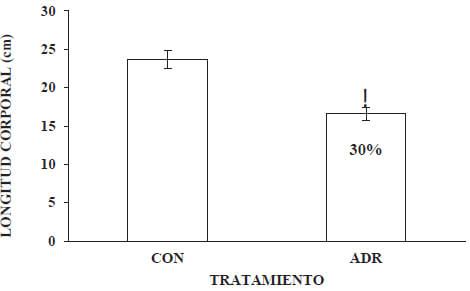
A las seis semanas post-tratamiento, el grupo ADR presentó una longitud corporal promedio significativamente menor que la del grupo CON, la cual fue de un 30%.
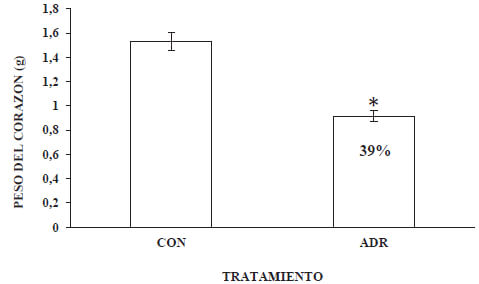
A las seis semanas post-tratamiento, el peso promedio del corazón del grupo ADR, fue significativamente menor que el del grupo CON. El grupo ADR presentó una disminución de peso promedio del corazón de 39%, respecto al grupo CON.
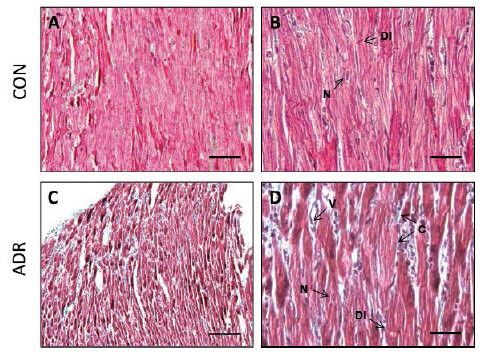
Los cortes histológicos de pared ventricular izquierda fueron coloreados mediante el método de Tricrómico de Manson para diferenciar el tejido conectivo del tejido muscular (Blandenier et al. 2004). Lo anterior con el propósito de visualizar indirectamente la extensión del tejido conectivo y sus posibles alteraciones en los grupos experimentales como resultado del tratamiento. Este método colorea las fibras musculares y el citoplasma, de color rojo, los núcleos de negro, los eritrocitos de anaranjado brillante y el tejido conectivo de color verde. Es una modificación del método de Mallory (Blandenier et al. 2004)
En el grupo CON (A y B), se observó la típica morfología del tejido muscular cardíaco, caracterizado por células alargadas, con uno o dos núcleos centrales ovales, que forman columnas que se anastomosan irregularmente, revestidas por una fina capa de tejido conjuntivo. En la unión entre dos células se puede distinguir una línea oscura transversal, la cual corresponde a las áreas especializadas para la unión llamadas discos intercalares (B). A diferencia de este, el grupo ADR (C y D) presenta un incremento en el tejido conectivo que rodea las columnas de las células musculares cardíacas. Este tejido conectivo, pareciera estar principalmente conformado por un componente celular, debido a la cantidad de núcleos que se pueden visualizar entre las células musculares cardíacas.
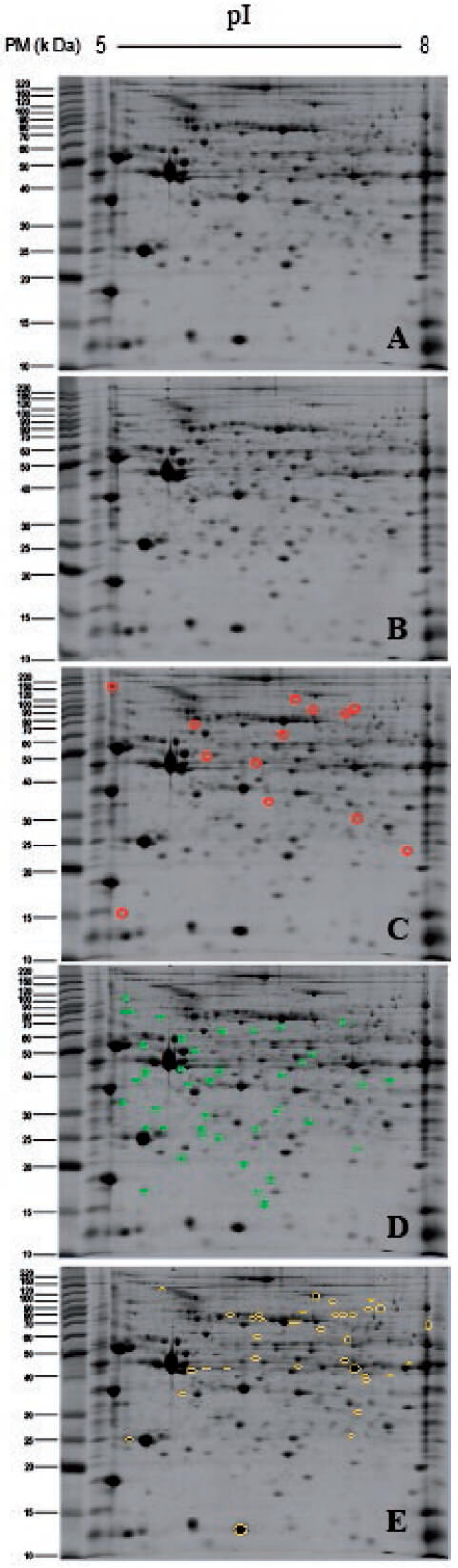
En la figura 3, se observa el perfil proteíco del grupo CON (A) y ADR (B). En el perfil proteíco del grupo CON (C), se señala los puntos proteicos que no pudieron ser evidenciados en el perfil proteíco del grupo ADR (B; 13 p.p.). Así mismo, se señalan en el perfil proteíco del grupo CON (D y E), los puntos proteícos que presentaron un cambio estadísticamente significativo (p ˂ 0,05 t-Students) en su abundancia relativa (DO) de ± 1,5 veces en el perfil proteíco del grupo ADR (75 p.p.), respecto a la abundancia de ese mismo punto proteico en el grupo CON. En el perfil D, se observaron aquellos puntos proteicos que incrementaron significativamente su abundancia relativa (DO > 1,5 veces y p ˂ 0,05; D; 40 p.p.) y en E, los que disminuyeron (DO ˂ 1,5 veces y p ˂ 0,05; E; 35 p.p.).
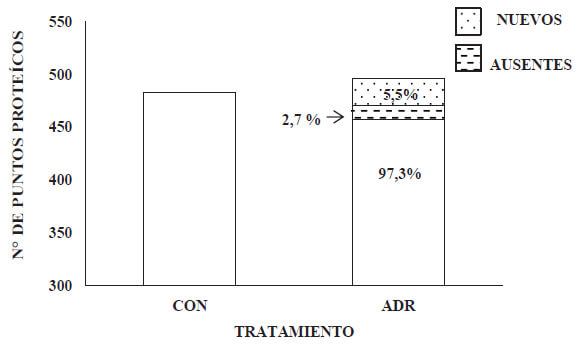
Al comparar los perfiles proteícos de ambos grupos experimentales, se encontró que del total de puntos proteicos presentes en el perfil proteíco del grupo ADR, 5,5 % de estos (26 p.p.), no estaban presentes en el perfil proteíco del grupo CON. Lo que representaba la presencia de puntos proteícos nuevos. No obstante, del total de puntos proteícos presentes en el grupo CON, un 97, 3 de estos estuvieron presentes en el perfil del grupo ADR, lo que representaba la ausencia de 2,7 % de estos.
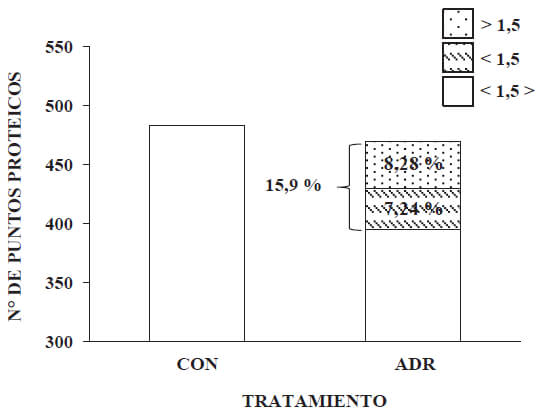
Del total de puntos proteicos pertenecientes a los perfiles proteómicos del grupo tratado con adriamicina, que coincidieron con los del perfil del grupo CON, 15,9 % de estos presentaron una abundancia relativa diferencial(±1,5 veces; p ˂ 0,05 t-Students). De estos, 8,28 %, presentaron un incremento en su abundancia relativa (> 1,5); mientras que 7,4 % (< 1,5), presentaron una disminución. Esto es un reflejo de la acción que ejerce la adriamicina sobre la expresión de proteínas cardíacas, a las 6 semanas post-tratamient
El cuerpo de resultados presentados en este trabajo, en cuanto a los signos evidenciados en el grupo experimental tratado con adriamicina, respecto al control, se corresponde y son consistentes con lo publicado por Núñez y colaboradores (2006), en relación a los signos característicos asociados al tratamiento quimioterapéutico con miembros de la familia de las antraciclinas, como la adriamicina. Estos incluyeron alopecia (Fig.1), evacuaciones líquidas al inicio del tratamiento, pérdida de los incisivos, además de resequedad lacrimal. Esto se debe a que las poblaciones celulares más afectadas por la acción de la adriamicina, son aquellas que poseen elevadas tasas de multiplicación celular, como las del folículo piloso, las del tubo digestivo, y las que forman los incisivos en el caso de los roedores. En ellas también se incluyen las células de la médula ósea y las del sistema reproductor (Núñez et al.2006). En el caso de los incisivos, en los roedores crecen continuamente durante toda la vida, a una velocidad de dos a cinco milímetros por semana, dependiendo de la especie. De allí, que al igual que con el folículo piloso, las células generadoras de los incisivos, también tienen una alta multiplicación celular, que sumado a la carencia de raíces profundas de estos, parecen ser afectadas por la acción citostática de la adriamicina.
Adicionalmente a estos signos, también se observó en uno de los animales del grupo ADR, una inflamación en el miembro posterior denominada clínicamente como eritrodisestesia palmo-plantar (PPE), la cual ha sido descrita como una inflamación parestesia de manos y pies que aparece con la quimioterapia con 5-fluorouracilo, capecitabina, citarabina y adriamicina (Hueso et al.2008). Otros nombres incluyen eritema acral (AE), eritema palmo-plantar, síndrome mano-pie, AE peculiar y reacción de Burgdorf. Los síntomas pueden aparecer en días o meses después de la administración del agente quimioterapeútico y parece depender de la dosis y la velocidad de administración (Hueso et al.2008). Pavey y colaboradores (2015) señalan que en un inicio, el paciente experimenta un hormigueo y/o parestesias de las palmas y plantas que evoluciona en una inflamación dolorosa, simétrica, y bien-delimitada con placas rojizas, la cual sigue con la descamación de la piel como última fase del proceso de resolución de los síntomas. En nuestro caso, la inflamación del miembro posterior se mantuvo hasta las seis semanas, lo cual pareciera ser insuficiente, para que estos síntomas desaparecieran.
La pérdida de la ganancia de peso corporal progresiva, evidenciada durante las seis semanas post-administración de adriamicina (Graf. 1), que en nuestro modelo animal fue de 57,76 %, estuvo acompañada por una reducción del 30% de su longitud corporal (Graf. 2) y de un 39% del peso del corazón (Graf.3). Nuestros resultados exhiben paralelismo con los resultados de Strauss y colaboradores (1998), quién empleando ratas neonatas de la cepa SpragueDawley, observó una disminución en la ganancia de peso corporal y una reducción de la pared ventricular izquierda, a las 6 semanas post-tratamiento con 9 mg/ kg p.c. de adriamicina. Estos efectos, pudieran inicialmente estar asociados, además del daño cardíaco, a daños hematológicos y sobre el tracto gastrointestinal, (Nuñéz et al., 2006). Lo anterior, en cuanto a la anemia generada, que inciden sobre su actividad y apetencia; y a la mala absorción de nutrientes, respectivamente. Ambos, afectando el desarrollo normal de nuestro modelo animal. Lo anterior, es una evidencia más de cómo los efectos tóxicos de la adriamicina pueden limitar severamente el desarrollo normal de un niño sobreviviente al cáncer. En este sentido, Lipshultz y Adams (2010) señalan que los sobrevivientes de cáncer infantil a largo plazo tratados con este agente antineoplásico, son 8 veces más susceptibles de morir de enfermedades cardiovasculares respecto a la población general, y 15 veces respecto a sus hermanos. Igualmente señalan que existen un amplio conjunto de evidencias que indican que los efectos tóxicos de adriamicina en el corazón son más frecuentes en personas muy jóvenes, particularmente en niños, donde la adriamicina induce un deterioro miocardial que puede afectar severamente su crecimiento. Debido a ello, los niños parecieran tener un riesgo mayor para desarrollar toxicidad cardíaca y en consecuencia desarrollar cardiopatías durante la etapa adulta (Trachtenberget al. 2011).
A nivel histológico, el incremento en el tejido conectivo observado en el grupo ADR, respecto al grupo CON, parece estar vinculado a una remodelación del miocardio que involucra necrosis y/o apoptosis de los cardiomiocitos, proliferación de fibroblastos y alteración no solo de los componentes del miocardio, sino de las mayores proteínas estructurales del espacio extracelular. Este incremento, es característico del tejido enfermo o necrosado, el cual es a la larga, reemplazado por tejido fibroso (Fibroblastos y fibras colágenas), que prolifera más de lo normal (Blandeiner y Montenegro, 2004; Gartner y Hiatt, 2008). En conejos adultos, tratados con adriamicina (2 mg/kg p.c. semanal), Gava y colaboradores (2013), encontraron una significativa reducción en la función sistólica, a las seis semanas, asociadas a distintas alteraciones a nivel histológico y ultraestructural. Tales alteraciones estuvieron vinculadas a necrosis y fibrosis intersticial, vacuolización y granulación intracitoplasmástica. Ivanová y colaboradores (2012), en un modelo de cardiotoxicidad crónica en ratas adultas, encontró que estas alteraciones morfológicas de los cardiomiocitos y de la función cardiaca, estaban vinculadas a un incremento en la actividad de metaloproteinasas de la matriz extracelular (MMP: del inglés “matrixmetalloproteinases”), a las 8 semanas post-tratamiento con adriamicina. De igual forma, Polegato y colaboradores (2015), encontró en ratones adultos, que la disfunción cardiaca inducida por adriamicina, estaba relacionada a la activación de la MMP-2. Estas MMP, son responsables de degradar los componentes de la matriz extracelular por lo que tienen una importante función en la remodelación miocardial, más aún si consideramos que en el corazón, el colágeno es la principal proteína de la matriz extracelular (D´Armiento, 2002). Basado en esto, se puede inferir que las alteraciones histológicas evidenciadas en el tejido cardíaco del grupo tratado con adriamicina, es consecuente con el desarrollo y el establecimiento de la característica cardiotoxicidad asociada a este antineoplásico (Gavaet al.2013), y como ha sido descrito en la insuficiencia cardiaca (Graham et al.2008) o de cualquier otra patología cardíaca (Spinale, 2007). Considerando que nuestro modelo animal pretende reflejar los efectos que sobre el desarrollo ejerce la adriamicina, se puede comprender, como niños sobrevivientes al cáncer, pueden presentar algún grado de cardiomiopatía en la etapa adulta, mucho tiempo después de haber culminado el tratamiento quimioterapéutico.
A nivel de perfil proteico, las alteraciones observadas en el grupo tratado con adriamicina, fueron consistentes, con el efecto que sobre la expresión de proteínas ejerce este agente, como resultado de su acción citostática y citotóxica. La ausencia de puntos proteicos, así como la disminución en su abundancia relativa debida a la administración de adriamicina, pareciera estar asociada a su acción citostática. Lo anterior, debido a su capacidad para intercalarse entre los pares de bases de la cadena de ADN (Vejpongsa et al. 2014), por lo que los procesos de replicación y de transcripción, se ven perturbados. Múltiples han sido las investigaciones que señalan el efecto que la adriamicina ejerce sobre la expresión de algunos genes (Ito et al.1990; Tokarska-Schlattner y col, 2010). Específicamente sobre la expresión de genes que codifican para músculo cardíaco, Ito y colaboradores (1990), observó que la adriamicina pareciera ejercer un efecto selectivo sobre la inhibición de estas. Empleando sistemas in vitro e in vivo, ellos observaron que la adriamicina reduce selectiva y significativamente, de un modo dosis-dependiente, la expresión de los genes sarcoméricos, α-actina, troponina I y la cadena ligera 2 de la miosina; así como también, la músculo-específica isoforma M de la enzima creatinina quinasa. Al comparar estos efectos con los generados por la actinomicina D, un inhibidor de la ARN polimerasa ADN-dependiente, no observaron tal reducción selectiva de la expresión de estos genes. A diferencia de estos, la adriamicina no afectó los transcritos de los genes que no eran músculo-específico, como lo son la enzima piruvatoquinasa, la cadena pesada de ferritina y la β-actina. Estos resultados no fueron observados en el músculo esquelético, en ninguno de los dos sistemas experimentales empleados. A nivel transcripcional, la adriamicina disminuye la expresión de phospholipasa C, una enzima crucial para la señalización del fosfoinositol y la homeostasia del calcio (Lienet al.2006). A nivel post-traduccional, las especies reactivas de oxígeno inducidas por adriamicina pueden oxidar los residuos de cisteína susceptibles de la creatinina quinasa mitocondrial, inactivando por ende su principal enzima reguladora de energía (Tokarsha-Schlattneret al.2002).
A través de análisis con microarreglos de ADN, se ha demostrado que la adriamicina puede modular la expresión de proteínas cardíacas relacionadas a la producción de energía y a su metabolismo, regulación de calcio, crecimiento celular, muerte, función citoesqueletal, adhesión celular y transducción de señales (Lienet al.2006; Simuneket al.2009). De estas, las proteínas relacionadas a la producción de energía y sus vías metabólicas son de particular importancia, debido a los grandes aportes de energía que requiere el corazón para su mantenimiento y funcionalidad (Chenet al.2007). Es por ello que la destrucción de las vías metabólicas que normalmente soportan la producción, transferencia y utilización de energía, es uno de los principales factores que contribuyen al deterioro del corazón. Chen y colaboradores (2006) a través de un análisis proteico de un modelo murino adulto de cardiotoxicidad inducida por 20 mg/kg de peso corporal de adriamicina, a las 72 horas, demostró que la fosfato triosa isomerasa, la β-enolasa y la flavoproteína de transporte de electrones ubiquinonaoxidorreductasa (ETF-QO del inglés electron-transfer flavoprotein-ubiquinoneoxidoreductase) quedan carboniladas después del tratamiento agudo con adriamicina. Las enzimas triosa fosfato isomerasa y la β-enolasa participan en la ruta glicolítica; la enzima isomerasa cataliza la interconversión entre gliceraldehído-3-fosfato y la fosfato dihidroxiacetona; y la β-enolasa cataliza la conversión de 2-fosfoglicerato a fosfoenolpiruvato. La ETF-QO es una flavoproteína de transporte de electrones deshidrogenasa, es el tercer punto de entrada a la cadena de transporte de electrones. Es una enzima que acepta electrones de la flavoproteína de transferencia de electrones en la matriz mitocondrial, y utiliza estos electrones para reducir la ubiquinona (Watmough et al. 2010). En mamíferos, esta ruta metabólica es importante en la beta oxidación de ácidos grasos, el catabolismo de aminoácidos y colinas, al aceptar electrones de múltiples acetil- CoA deshidrogenasas (Watmoughet al. 2010). Pereira y colaboradores (2016), en el corazón de un modelo murino adulto con cardiomiopatía crónica inducida por adriamicina, encontraron una disminución en la respiración mitocondrial debida a la pérdida de citrocromo C y cardiolipina. Lo anterior, trayendo como consecuencia, la incapacidad para responder al aumento de la sobrecarga cardíaca, acelerando por ende, el envejecimiento cardíaco. Es de esperar que la inactivación de todas estas proteínas cardíacas, comprometa la producción de energía y contribuya con el deterioro de la función cardíaca observada en sobrevivientes al tratamiento quimioterapèutico con adriamicina.
Por otra parte, la presencia de nuevos puntos proteicos, así como el incremento en la abundancia relativa de otros, pudiera estar asociada a la expresión de proteínas vinculadas a los mecanismos de restauración de la homeostasis celular. Entre ellos, las proteínas de estrés o de choque térmico (Hsp del inglés Heat Shock Proteins), las cuales constituyen uno de los sistemas endógenos de protección y restauración de la homeostasis celular, mejor conservado y caracterizado (Coronato et al.1999). La expresión de los genes que codifican para estas proteínas puede ser inducida frente a condiciones de estrés capaz de evocar tal respuesta, tal como el estrés oxidativo generado por la administración de adriamicina (Angsutararuxet al.2015; Asencio-Lopéz et al.2017). En este sentido, Kumar y colaboradores (2011), evaluando los perfiles proteicos en un modelo murino adulto de cardiomiopatía crónica por 2, 5 mg/kg de peso corporal de adriamicina, a las ocho semanas post-tratamiento, encontró que las proteínas que presentaron mayores cambios respecto al perfil proteico del grupo control, estuvieron principalmente representadas por proteínas vinculadas en la respuesta al estrés celular. Entre ellas se encuentran chaperonas moleculares, hidrolasas, oxidoreductasas, proteínas citoesqueletales, quinasas transportadores de fosfolípidos, endopeptidasas y coactivador de transcripción. Entre las chaperonas moleculares, la Hsp25, fue una de las proteínas sobreexpresadas. El incremento de la expresión de esta chaperona, si bien ha sido vinculada a procesos de cardioprotección (Strauss et al.1998; Linet al.2015), otros lo vinculan al daño cardíaco por inducción de apoptosis (Dohkeet al.2006; Vedamet al.2010). Otro ejemplo lo constituye, la enzima nuclear Poli(ADPRibosa) polimerasa-1 (PARP-1), también conocida como poli(ADP-ribosa) sintetasa y poli (ADP-ribosa) transferasa. PARP-1, es una proteína muy conservada en la escala filogenética, que participa activamente en los procesos de reparación de rupturas del ADN, simples y dobles. PARP-1 se activa principalmente en respuesta a daños en el ADN inducidos por diferentes agentes genotóxicos como la adriamicina, induciendo necrosis (Shinet al.2017).
En este sentido, los cambios selectivos en la expresión de los genes que ejerce la adriamicina sobre los cardiomiocitos, pudieran explicar las alteraciones en el perfil proteico, histológicas y biométricas, observadas en el grupo tratado con adriamicina. Tales alteraciones, son las que pudieran incidir, directamente o indirectamente, en el desarrollo normal de los niños sobrevivientes al cáncer.
Las alteraciones en las características biométricas, asociadas a la administración de la adriamicina, es un reflejo del efecto adverso, que ejerce este antineoplásico en el desarrollo normal de nuestro modelo animal. De igual forma, el incremento en el tejido fibroso asociado a la administración de la adriamicina, es consecuente con el establecimiento de un modelo de cardiotoxicidad, como resultado de procesos de remodelación miocárdica producto de la acción citostática y citotóxica, que ejerce este agente, sobre la expresión de las proteínas cardiacas.
Al Consejo de Desarrollo Científico y Humanístico (C.D.C.H., proyecto N° 09-8187-2011) de la Universidad Central de Venezuela y a Proyecto LOCTI-UCV 2010. A Marianela Rodríguez y al Dr. Marco Álvarez por su apoyo en el análisis histológico.