Para el Instituto de Medicina Tropical, desde su fundación hace 70 años, la Enfermedad de Chagas (ECh) ha sido motivo de investigaciones pioneras realizadas por Félix Pifano y Alberto Maekelt, en el área de la epidemiología y el diagnóstico destacándose los aportes en diagnóstico serológico, la elaboración de antígeno de Trypanosoma cruzi y la evaluación de la trasmisión en áreas rurales. En la Sección de Inmunología (SI) se realizan varias técnicas para el diagnóstico parasitológico, inmunológico y molecular de la ECh en sus fases aguda y crónica. Suman 244 casos agudos evaluados en la SI desde 2007 cuando se describe la primera microepidemia de trasmisión oral para Venezuela y la más numerosa en Latinoamérica. La detección simultanea de parásitos o su ADN en sangre, y de anticuerpos específicos en toda la población expuesta facilita el diagnóstico temprano para tratar los casos de manera inmediata evitando consecuencias fatales. En relación a los casos crónicos, la afluencia promedio de usuarios en el período estudiado (2013-2016) es de 879 personas/año resultando entre 11-15% los positivos al diagnóstico. Estos se detectan principalmente en personas “picadas por chipos”, en cardiópatas y en el grupo mayor de 50 años en quienes la positividad es del 25% de los usuarios, diagnóstico tardío cuando el beneficio del tratamiento anti-parasitario es prácticamente nulo. La data de los pacientes crónicos no aporta indicación de trasmisión en grupos vulnerables como niños y embarazadas, pues el número de usuarios es muy bajo. Es necesario incorporar el diagnóstico de la ECh en protocolos de rutina varios síndromes clínicos (fiebre prolongada, derrame pericárdico), en pacientes inmunosuprimidos, embarazadas, niños, conscriptos, programas de trasplantes, entre otras. Es urgente considerar la encuesta nacional de serología de ECh en el grupo etario de 5 a 20 años.
Palabras clave: Enfermedad de Chagas; serología; tratamiento; casos agudos; casos crónicos; Instituto de Medicina Tropical, UCV.; Venezuela; Tripanosomiasis.
For the Institute of Tropical Medicine, since its foundation 70 years ago, Chagas Disease (ChD) has been the subject of pioneering research carried out by Félix Pifano and Alberto Maekelt, in the area of epidemiology and diagnosis, highlighting the contributions in serological diagnosis, the preparation of Trypanosoma cruzi antigen and the evaluation of transmission in rural areas. Several techniques for the parasitological, immunological and molecular diagnosis of ChD in its acute and chronic phases are carried out in the Immunology Section (IS). There are 244 acute cases evaluated in the IS since 2007 when the first oral transmission microepidemic was described in Venezuela, the largest in Latin America. The simultaneous detection of parasites or their DNA in blood, and specific antibodies throughout the exposed population facilitates early diagnosis to treat cases immediately avoiding fatal consequences. In relation to chronic cases, the average influx of users in the period studied (2013-2016) was 879 persons / year, resulting in 11-15% positive diagnosis. These are detected mainly in people "bitten by chipos", in heart disease and in the group older than 50 years in whom positivity is 25%, late diagnosis when they cannot be benefited by anti-parasitic treatment. The data of chronic patients does not provide an indication of transmission in vulnerable groups such as children and pregnant women because the number of users is very low. It is necessary to incorporate the diagnosis of ChD into routine protocols of various clinical syndromes (prolonged fever, pericardial effusion), immunosuppressed patients, pregnant women, children, conscripts, transplant programs, etc. It is urgent to consider the national survey of serology of ChD in the age group of 5 to 20 years.
Key words: Chagas Disease; serology; treatment; acute cases; chronic cases; Tropical Medicine Institute; Venezuela.
La Enfermedad de Chagas (ECh) es una zoonosis parasitaria que puede afectar al humano. Su agente causal es el protozoario hemoflagelado Trypanosoma cruzi, endémica en América donde es transmitida por varios géneros de triatominos hematófagos. Los mecanismos de infección de la ECh se dividen en dos grandes grupos: uno en el cual está involucrado el vector y otro en los cuales no es indispensable la participación del mismo. La transmisión vectorial es exclusiva de países donde habita el insecto y las condiciones climáticas y sociales que permiten su existencia. De manera habitual las personas adquieren la ECh cuando son picados por el triatomino y las heces del mismo contentivas de tripomastigotes metacíclicos (formas parasitarias de diseminación altamente infectantes), contaminan la herida producida por la picadura o las mucosas (Rassi et al. 2010). En ocasiones, animales y humanos ingieren bebidas o alimentos contaminados con las heces infectadas de los triatominos (Coura, 2006) o mediante las secreciones anales de didélfidos infectados con T. cruzi (Deane et al. 1984). En el segundo grupo de transmisión, el vector no se encuentra directamente involucrado como la que ocurre por accidentes en el laboratorio por la manipulación de material infectante con muestras biológicas o mamíferos infectados (Herwaldt 2001; Colmenares et al. 2015) y la transmisión hombre-hombre a través de transfusiones sanguíneas (Bern et al. 2011), transplacentaria (Carlier & Truyens. 2010) y por trasplantes de órganos (Favaloro et al. 2015).
En el vertebrado, el parásito se multiplica por fisión binaria intracelularmente en forma de amastigotes y el mecanismo de acción patógena se centra en la destrucción celular una a una pudiendo afectar casi todos los tejidos del hombre, siendo el corazón el principal órgano blanco de la fisiopatología de la enfermedad (Rassi et al. 2010). Aproximadamente el 30% de las personas infectadas desarrollan la fase aguda de la enfermedad con manifestaciones clínicas de intensidad variable caracterizada por fiebre alta, edemas facial o en miembros inferiores, rash, hepatomegalia, miocarditis, derrame pericárdico y gran postración. En pacientes infectados vectorialmente con puerta de entrada cutánea se puede apreciar el Chagoma de inoculación en piel y el complejo oftalmo- ganglionar denominado “signo de Romaña” (Prata, 2001). De no sobrevenir un desenlace fatal, de mayor frecuencia cuando la transmisión es oral (Noya et al. 2015), la fase sintomática se apaga progresivamente y el paciente pasa a la fase crónica. El 70% de los pacientes en fase crónica no desarrolla la enfermedad o presentan mínimos cambios electrocardiográficos, de hecho se encuentran asintomáticos. Esta fase se denomina indeterminada también llamada ECh crónica asintomática. El resto de los pacientes en fase crónica (30%) transita progresivamente por los estadios caracterizados por Kuschnir (1985) hacia la miocardiopatía e insuficiencia cardíaca con cardiomegalia y arritmia de variable intensidad (Viotti & Vigliano. 2015).
Los estudios pioneros en Venezuela se deben en especial a José Francisco Torrealba, quien desde el año 1932 inició estudios en el estado Guárico (Torrealba, 1935) e introdujo el xenodiagnóstico; mientras que Félix Pifano (1941) creó la base para los estudios epidemiológicos y clínicos en el país a través de sus trabajos publicados como el realizado en el estado Yaracuy. Ambos autores venezolanos resaltan su magnitud como problema de salud pública y social en nuestro país, así como la importancia de la pobreza y del "rancho" de techo de palma y paredes de bahareque en el mantenimiento de esta zooantroponosis.
En el Instituto de Medicina Tropical (IMT) de la Universidad Central de Venezuela (UCV), Alberto Maekelt (1960) pone a punto su protocolo para la preparación de antígenos, el cual todavía es utilizado en el país, y Pifano (1960) publicó las primeras cifras nacionales de prevalencia, que en algunas localidades rurales llegaba hasta el 45%, estimándose en 500.000 de 7.000.000 el número de venezolanos infectados por T. cruzi, con tasas de miocardiopatía de 50% en personas infectadas y de 20% en la población rural total.
Maekelt, en la década del 50 detectó 12% de seropositivos en donantes de sangre en el estado Carabobo (Maekelt, 1959). Pocos años después, se establecería que de 3,5 a 5% de los hemodonadores en Venezuela eran portadores de anticuerpos a T. cruzi (Pifano et al. 1961). Al comprobar en Venezuela la transmisión de T. cruzi por transfusiones (Salazar et al. 1962), la División de Endemias Rurales, conjuntamente con el IMT de la UCV emprendieron un estudio nacional de seroprevalencia para comprobar la transmisión de T. cruzi por transfusiones, empleando la Reacción de Fijación de Complemento en bancos de sangre y otros centros asistenciales. La seroprevalencia global se estableció en 6% en 152.487 muestras examinadas (Guerrero et al. 1965).
El Dr. Alberto Maekelt fundó la Sección de Inmunología (SI) en el IMT, estableciendo las bases del diagnóstico con la producción del antígeno soluble de epimastigotes de T. cruzi a gran escala, abasteciendo las dependencias del Ministerio de la Salud y de los Bancos de Sangre nacionales para el diagnóstico de la ECh por Hemaglutinación Indirecta e Inmunofluorescencia durante 43 años, y después por ELISA a partir del año 1998 (Díaz-Bello et al. 2008). Esta responsabilidad se extiende hasta la actualidad, ya no con la amplitud de esos años pero si con el prestigio heredado de la responsabilidad y profesionalismo de los sucesivos integrantes de dicha Sección. En el 70 aniversario de la fundación del Instituto de Medicina Tropical, la SI-IMT hace un homenaje a sus fundadores en las personas de los Dres. Félix Pifano y Alberto Maekelt, quienes hicieron grandes y pioneros aportes en el conocimiento de la Enfermedad de Chagas en Venezuela (Figura 1).

La SI-IMT ha tenido una participación protagónica en los brotes de ECh aguda por transmisión oral y ha divulgado su conocimiento en publicaciones, conferencias, programas de radio y televisión siendo muy satisfactorio que algunos brotes hayan sido identificados por otros grupos médicos del país. Sin embargo, es nuestra permanente preocupación concientizar a los servicios de salud sobre la presencia de la ECh no sólo en fase aguda, la cual tiene la grave consecuencia de ser eventualmente letal de no diagnosticarse y tratarse oportunamente, sino también el reconocimiento de la fase crónica, insospechada por los médicos incluyendo especialistas, quienes no se plantean el diagnóstico de la ECh de entrada en pacientes con manifestaciones cardiológicas insipientes u otras evidentes de miocardiopatía chagásica añadiendo años sin tratamiento anti-parasitario a los ya acumulados por la dinámica de evolución silente de esta patología. El presente artículo tiene como objetivo comunicar algunas experiencias del trabajo de la SI-IMT en la década 2007-2016 relativa a los casos agudos y algunos datos de la rutina de la consulta externa del período 2013-2016, a fin de conocer datos epidemiológicos, reforzar el criterio diagnóstico y aportar recomendaciones útiles al Programa Nacional de Control de la Enfermedad de Chagas.
Población en estudio: Consideramos como población los solicitantes de diagnóstico en la Consulta Externa del IMT. De este grupo se rescataron las historias en físico de 3517 personas desde el año 2013 al 2016 y los resultados de laboratorio de 1441 usuarios del año 2012. De allí que para el año 2012 sólo se dispone del dato de prevalencia más no de los datos demográficos. Lamentablemente, este estudio no pudo ser mayor por la sustracción de computadores y respaldos ocurridos a la SI durante el año 2016. La segunda población en estudio es la relativa a los casos agudos, los cuales no están incluidos en la casuística anterior. Como su nombre lo indica, estos pacientes se encuentran en situación de emergencia, son la mayoría referidos con otra impresión diagnóstica. Estos pacientes no ingresan en la rutina de la Consulta Externa y el abordaje diagnóstico es diferente.
Registro de ingreso: Al solicitar el diagnóstico de ECh se llena una pequeña historia con la identificación, sexo, edad, procedencia, motivo de consulta y teléfonos. Los pacientes acuden al IMT de manera voluntaria, por haber sido picados por triatominos, por resultar positivos en Banco de Sangre o referidos por el médico tratante.
Diagnóstico de rutina: Atendiendo las recomendaciones de la Organización Mundial de la Salud (OMS), se deben realizar dos pruebas de diagnóstico con fundamento diferente de manera indistinta. Para el diagnóstico de rutina se realiza el Ensayo Inmuno- Enzimático (ELISA) y Hemaglutinación Indirecta (HI) o Aglutinación Directa (AD). Adicionalmente, en la actualidad se practica la confirmación del diagnóstico utilizando técnicas de biología molecular como la reacción en cadena de la polimerasa (PCR, por sus siglas en ingles).
Ensayo Inmuno-Enzimático (ELISA): Partiendo del método de Voller et al. (1976) se practicaron modificaciones para estandarizar el ELISA como sigue. El antígeno se fijó a la fase sólida (placas de poliestireno MaxiSorp NUNC) a una concentración final de 1 μg/50μl en PBS ph 7,2. Se agrega por duplicado 50ml de los sueros, diluidos 1/50 en solución de lavado (SL) PBS pH 7.2-Tween 20 al 0,05% con leche descremada (LD) al 5% y se incuba a 37°C por 40 min en cámara húmeda. Las placas se lavan 4 veces con SL en lavador automático TECAN y luego se agrega 50ml de la anti-IgG humana conjugada a fosfatasa alcalina diluida 1/500 en SL-LD y se incuba a 37°C por 40 min en cámara húmeda. Transcurrido el tiempo se realizan 4 nuevos lavados con SL y se agrega 50ml del substrato para-nitrofenilfosfato, diluido en buffer dietanolamina pH 9.6 (1 mg/ml) y se incuba a 37°C por 10 min. Para detener la reacción se añade 50ml de NaOH 1N y se realiza la lectura de absorbancia (Abs) a 405 nm en un lector de placas ELISA TECAN Spectra Classic. Se fijó el punto de corte por el promedio de la densidad óptica más 2 desviaciones estándar de 100 sueros de pacientes con resultados de ELISAIgG negativos. Valores de Abs menores a 0.200 se consideran negativos y mayores a 0.230 positivos. Los resultados con valores entre estas dos cifras se repiten o se toma una nueva muestra al paciente.
Hemaglutinación Indirecta: Glóbulos rojos de carnero fueron tratados con ácido tánico y sensibilizados con antígenos de epimastigotes de T. cruzi. Los glóbulos rojos tanizados y sensibilizados al 1%, fueron añadidos a diluciones seriadas de los sueros, agitados y dejados en reposo durante 16 horas a temperatura ambiente hasta la lectura de los resultados (Díaz-Bello et al. 2008).
Cultivo agar-sangre: Dos ml de sangre se cultivaron en medio bifásico y revisados periódicamente por al menos 3 meses (WHO, 2002).
Reacción en cadena de la polimerasa (PCR): Para la extracción de ADN se utilizaron 5 ml de sangre total con EDTA como anticoagulante mezclado con igual volumen de 6M Guanidina HCl /0,2M EDTA (Sturm et al. 1989). La reacción de amplificación se dirigió a la detección de un fragmento de 330 pares de base (pb) perteneciente al ADN del minicírculo del kinetoplasto de T. cruzi (Schijman et al. 2003).
Abordaje del paciente con resultado positivo al inmunodiagnóstico: Se les refiere a la consulta de Cardiología del IMT cuya especialidad es el manejo clínico de la ECh y se le da cita en nuestra consulta clínica para evaluar la pertinencia de administrar tratamiento anti-parasitario.
Abordaje del paciente agudo: Cuando la notificación es del interior del país, se solicita el envío de tres tubos: tapa roja, tapa morada (EDTA) y tapa azul (Citrato de Sodio), para la serología (determinación de IgM e IgG específicas por ELISA), Reacción en cadena de la polimerasa (PCR) y cultivo/inoculación en ratón, respectivamente. Si el paciente está hospitalizado en la región capital, nos trasladamos para conocer la historia, examinar al paciente y tomar las muestras.
Tratamiento: Dependiendo de la disponibilidad se le administra benznidazol (6 mg/kg/día por 60 días) y onifurtimox (8 mg/kg/día por 90 días). Se le da tratamiento programado a cualquier persona con serología positiva por dos métodos a quien se le solicita hematología, química sanguínea, electrocardiograma y Rx de tórax. El seguimiento inicial es quincenal, advirtiéndole de los efectos colaterales y con consentimiento informado firmado por el paciente o su custodio. En caso agudo se le indica de inmediato y se hace seguimiento semanal, también con consentimiento escrito. En general, el tratamiento debería ser ofrecido a los adultos hasta los 50 años pero se evita en pacientes con cardiopatía avanzada (WHO, 2002).
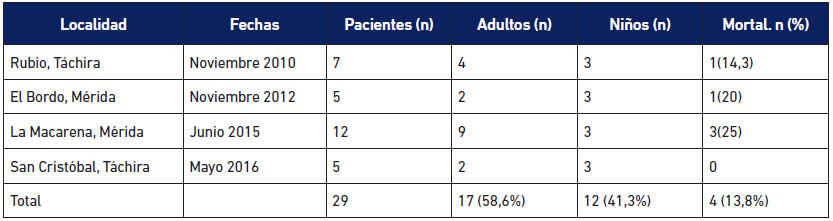
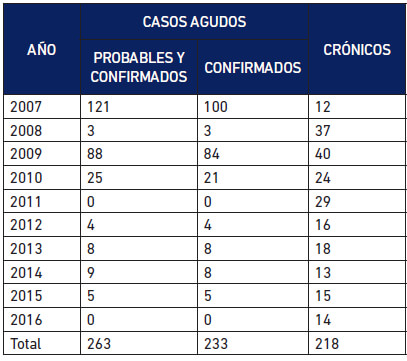
Casos agudos de los brotes orales: Provienen de los brotes de transmisión oral ocurridos desde el año 2007. Desde entonces se registran 14 brotes de ECh de transmisión oral en Venezuela (Alarcón de Noya et al. 2015), de los cuales la SI-IMT ha participado en nueve (Tabla 1A). Se contabilizan 244 casos agudos en total distribuidos en 178 niños y 66 adultos, con 9 personas fallecidas. En la Tabla 1B se muestran los casos registrados en otros brotes orales en el país.
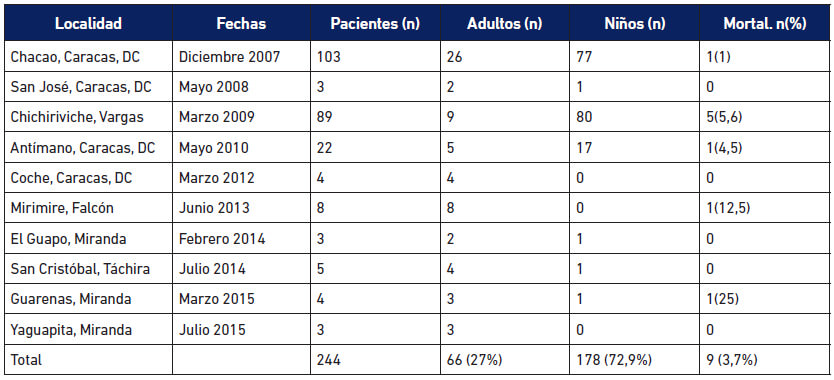
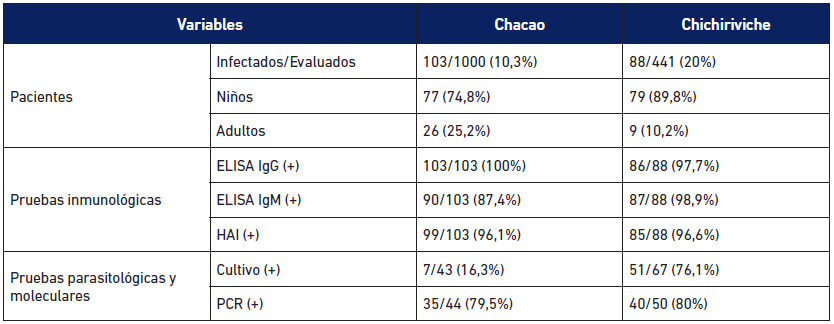
Dos microepidemias se registraron en escuelas públicas, la primera urbana, en el Municipio Chacao en Caracas afectó a 103 personas (Alarcón de Noya et al. 2010); y la segunda una escuela rural en Chichiriviche de la Costa, Estado Vargas afectando 88 personas (Alarcón de Noya et al. 2016). En las encuestas epidemiológicas en estas dos microepidemias, el vehículo común probable de transmisión lo constituyó un jugo de frutas preparado artesanalmente, que para el caso de Chacao se evidenció una relación estadísticamente significativa entre la ingesta del jugo de guayaba y la serología positiva (Alarcón de Noya et al. 2010). El abordaje diagnóstico y los resultados encontrados en situación de emergencia en Chacao fue publicado en detalle (Alarcón de Noya et al. 2012). En la Tabla 2 se comparan los estudios de laboratorio en la población expuesta y en infectados por T. cruzi en las dos microepidemias escolares atendidas por la SI-IMT, Chacao 2007 y Chichiriviche de la Costa 2009.
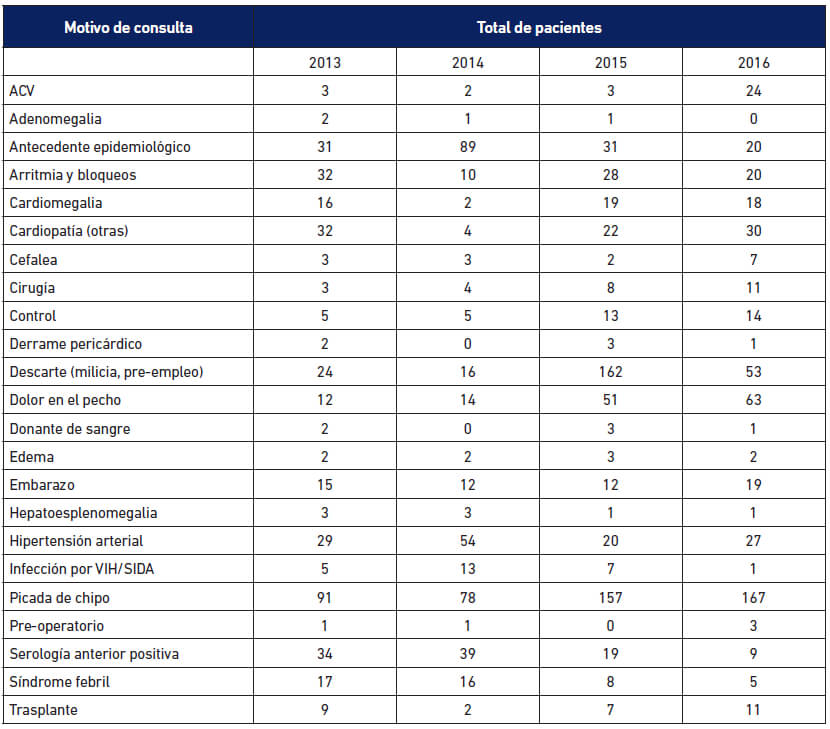
El número total de pacientes evaluados en la Consulta Externa de la SI-IMT en el quinquenio 2012-2016 fue de 4958. Sin embargo, solo se logró obtener los datos demográficos de 3517 personas para el período 2013-2016. El motivo de la solicitud del examen de laboratorio es muy variado tal como puede apreciarse en la Tabla 3 en la cual se muestran los motivos de consulta distribuidos por año durante el periodo 2013 al 2016. Destacan la picadura del vector, poseer antecedentes epidemiológicos (familiares con ECh, proceder de área endémica), serología positiva anterior (generalmente en bancos de sangre) y el descarte. Este último renglón incluye aspirantes a ingresar en el ejercicio militar, pre-empleo en algunas empresas, algunos pacientes inmunosuprimidos, entre otras. Por otra parte, llama la atención las pocas solicitudes en embarazadas, en pacientes con VIH y en personas en programa de trasplantes, tanto a los donantes como a los receptores.
La distribución por sexo en 3517 personas solicitantes fue de 51% en mujeres y 49% en varones. La procedencia de los usuarios para el período 2013-2016 se ilustra en la Figura 3, donde destacan las solicitudes de personas provenientes del Estado Vargas. Sin embargo, cuando se analiza la procedencia de las personas infectadas, estas provienen en su mayoría de Caracas y el Estado Miranda (Figura 4).
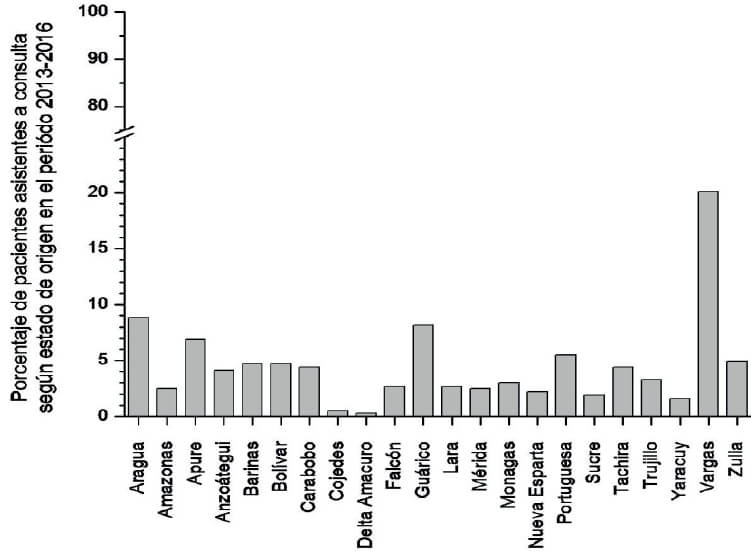
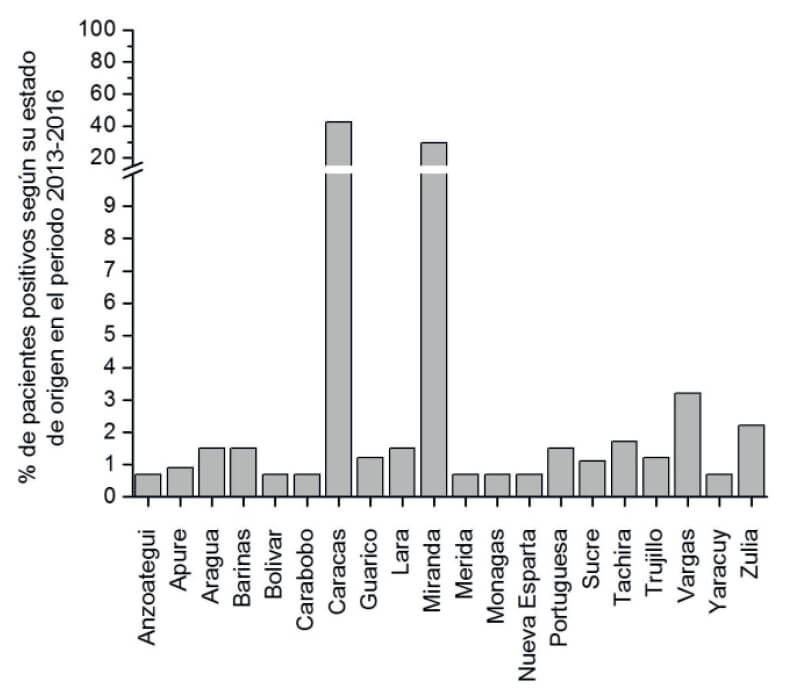
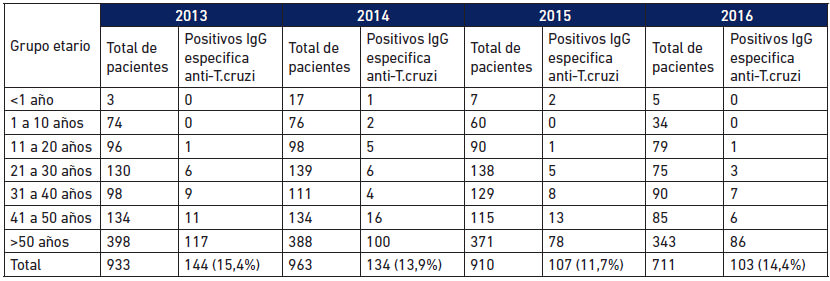
La Tabla 4 recoge la información general relativa al número de usuarios, número de positivos en la serología en dos pruebas de diagnóstico diferentes y su distribución por grupo etario para el período 2013-2016. Se aprecia la poca afluencia de niños y mayor positividad (de 21 a 29%) en el grupo etario > de 50 años.
Pacientes tratados con medicamentos anti-Trypanosoma cruzi: Se nos presentan las dos situaciones de la ECh: el tratamiento en fase aguda y el tratamiento de los pacientes en fase crónica. La Tabla 5 muestra el número total de personas tratados en la SI-IMT. Deben descontarse 21 personas tratadas en el brote de Chacao a quienes se les administró tratamiento como casos probables por vínculo epidemiológicos pero no se les demostró infección por T. cruzi, por lo que el número de pacientes en fase aguda demostrada tratados es de 242. El total de pacientes diagnosticados por año contrasta con el número de los pacientes tratados, especialmente en lo que se refiere al tratamiento de pacientes crónicos.
Existen varias formas de llegar al diagnóstico de la ECh siendo las más frecuentes a través de los bancos de sangre donde se examina un reducido sector de la población, en el cual el donante no necesariamente se entera del resultado de los exámenes practicados a su donación y el descarte en personas con cardiopatía (cardiomegalia o arritmias). Tampoco se sospecha en casos agudos no asociados a la presencia del vector, constituyéndose los casos agudos de transmisión oral en un elemento de reciente descubrimiento en la epidemiología de la ECh en Venezuela. La inexistencia del despistaje obligatorio de infección por T. cruzi (por ejemplo en embarazadas, niños, certificados médicos) contribuye al desconocimiento de la situación actual de la transmisión de T. cruzi. De aquí nuestra permanente preocupación por concientizar a los servicios de salud sobre la existencia de casos agudos de alta letalidad debido a la infección oral por T. cruzi y a la presencia de la fase crónica asintomática de la ECh. En el primer caso, el diagnóstico es responsabilidad de los servicios médicos de emergencia y en el segundo caso, el diagnóstico temprano sólo es posible por la práctica de la serología en programas de vigilancia epidemiológica a nivel nacional con filtros de diagnóstico, por ejemplo al entrar en la primaria, al terminar el sexto grado, al ingresar a la universidad, en embarazadas y en los certificados de salud en los exámenes de pre-empleo en toda la población.
Para diagnosticar la ECh en sus diferentes presentaciones clínicas hay que sospecharla, de aquí que es necesaria la incorporación de este diagnóstico en los protocolos del síndrome febril prolongado de causa desconocida, en el síndrome edematoso, en el hepatoesplénico, en conjuntivitis, en síndrome ganglionar, en pacientes con VIH-SIDA, en trasplantes, entre otros. No todas las personas que se infectan se enferman, y no todas las personas que adquieren la enfermedad desarrollan la fase aguda. Los pacientes en su mayoría, pasan a la fase crónica inaparente, asintomática sin mayores daños aparentes detectables por los exámenes de rutina. En este punto, es importante destacar que la forma clínica de presentación de la ECh en su fase aguda (cuando se presenta) es muy diferente a la fase crónica y por otra parte, la forma aguda por el mecanismo de infección transcutánea es diferente a la infección por vía oral.
Mantenemos que el diagnóstico de la fase aguda en líneas generales es casual, accidental y por tanto inesperado. No se plantea como diagnóstico de primera impresión diagnóstica, a menos que se encuentre vinculado con otros casos agudos ya diagnosticados. Por otra parte, el diagnóstico confirmado de la ECh producto de un despistaje por motivos laborales, por donación de sangre o por vinculación con un pariente infectado, es siempre una sorpresa tanto para el paciente como para el médico.
Los brotes de ECh de transmisión oral nos presentan una nueva realidad epidemiológica (Alarcón de Noya & Noya. 2015) ya que estamos frente a la diseminación y domiciliación de una plaga de triatominos hematófagos con una especie frecuentemente reportada en el país y registrada en la región capital como es Panstrongylus geniculatus, vector que además se encuentra infectado en el 75% de los ejemplares examinados en el IMT (Carrasco et al. 2014). Desde 2007 se han reportado 14 episodios de ECh de transmisión oral en el territorio nacional con mortalidad promedio de 5% (Alarcón de Noya et al. 2015), y hasta de 25% en el brote de Mérida 2015 (Áñez et al. 2016). Han sucedido uno ó dos brotes anuales desde 2007 y en septiembre 2017 se diagnosticó en Colombia, la infección aguda por T. cruzi en dos niños fallecidos provenientes de Táriba, Estado Táchira. La ocurrencia de transmisión oral se ha repetido varias veces a nivel central (región capital, Estados Vargas y Miranda) y en el occidente del país en los Estados Falcón, Mérida y Táchira. Como quiera que P. geniculatus está ampliamente distribuido en todo el territorio nacional, los brotes de transmisión oral y los casos agudos transcutáneos pueden aparecer en cualquier estado donde exista la presencia de triatominos hematófagos. La fase aguda de ECh es difícil de diagnosticar, no por los exámenes de laboratorio sino porque la ECh no se encuentra en los protocolos clínicos habituales y puede confundirse con las arbovirosis, infección urinaria, paludismo y otras infecciosas.
La aplicación simultánea del inmunodiagnóstico por ELISA para la detección de anticuerpos específicos IgM e IgG fue la clave para la detección de los casos agudos en la población expuesta. Los ensayos parasitológicos y moleculares sólo se pudieron realizar en un segmento de la población infectada pues de entrada se requería del diagnóstico del caso confirmado para la inmediata administración de tratamiento anti-parasitario. Con la experiencia de la primera microepidemia (Chacao), los resultados para la detección del parásito en la población afectada de Chichiriviche fueron más efectivos. El diagnóstico de laboratorio debe ser abordado con todas las pruebas de diagnóstico posible, no sólo para la determinación de los anticuerpos específicos sino también para la demostración del parásito. El tratamiento anti-parasitario, solamente expedido por las Direcciones de Salud Ambiental del Ministerio Popular para la Salud, debe ser administrado inmediatamente posterior al diagnóstico en los casos comprobados y en aquellos sintomáticos vinculados epidemiológicamente. La evolución suele ser rápida y puede presentarse un desenlace fatal por derrame pericárdico severo y arritmia.
La motivación para solicitar el diagnóstico es variable. En los datos de la consulta externa del IMT, la más frecuente es la picadura de chipo seguida por “descarte”. En este ítem se incluyen aquellas personas con resultado positivo en banco de sangre. Este motivo está mal registrado pues dependiendo del entrevistador cuando una persona tiene un resultado positivo en banco de sangre lo puede incluir en “descarte, antecedentes epidemiológicos, serología anterior positiva o donante de sangre”. La afluencia de niños, embarazadas y personas jóvenes es baja, por lo tanto una de nuestras recomendaciones es la incorporación del despistaje de la ECh de rutina en grupos bajo riesgo como niños, embarazadas, conscriptos, pre-empleo, en quienes el tratamiento anti-parasitario tiene indicación.
En relación con las embarazadas, el despistaje de la ECh debería estar incluido en las pruebas de infecciones del embarazo que pueden comprometer al feto (TORCH) por el solo hecho de ser un país endémico de ECh. En este sentido, hemos considerado proponer las siglas TORCHCh en la cual Ch representaría “Chagas”. No obstante, esta iniciativa requiere de una decisión política más que académica. Venezuela fue el primer país donde se detectó la transmisión congénita de la infección por T. cruzi (Dao, 1949). Desde entonces las notificaciones de transmisión vertical se reducen a tres casos más (Gavaller, 1953; Suárez et al. 2010; Alarcón de Noya et al. 2017), los dos últimos ocurridos durante la fase aguda de la ECh transmitida oralmente demostrándose la presencia del parásito en los órganos fetales (Alarcón de Noya et al. 2017; Suárez et al. 2010). La presencia tan extendida del vector en el país y la presencia del ciclo urbano de T. cruzi en ciudades como Caracas (Herrera, 2014) son motivos suficientes para practicar la serología de la ECh en la embarazada venezolana independientemente de su lugar de procedencia. Si bien la administración de medicamentos anti-T. cruzi está contraindicada durante el embarazo, la positividad en una embarazada advierte al médico de los riesgos a los cuales puede exponerse al feto y su obligatoriedad de descarta un caso congénito. El tratamiento de mujeres en edad fértil ha disminuido considerablemente la aparición de casos congénitos (Sosa-Estani et al. 2009).
La fase crónica puede ser silente en el 70% de los casos crónicos ó puede ser sintomática aun en personas jóvenes quienes evolucionan rápidamente a la miocardiopatía chagásica caracterizada por cardiomegalia y arritmias (Viotti & Vigliano. 2015). En las dos circunstancias, el diagnóstico siempre es tardío, ya que la infección ha ocurrido generalmente en la niñez y el paciente ha evolucionado silenciosamente a la cronicidad sin recibir tratamiento el cual es de menor eficiencia durante la fase crónica de la enfermedad. Nuestro criterio es administrar tratamiento específico a aquellas personas que lo puedan tolerar y quienes aún no se encuentran en fases terminales (Kuschnir II y III). En el período evaluado 2013-2016, la afluencia de personas menores de 20 años fue muy baja y el porcentaje de positividad es más frecuente en personas mayores de 50 años lógicamente porque son referidas por cardiólogos cuando la ECh ya muestra todas sus características clínicas.
En diez años hemos administrado tratamiento antiparasitario a un poco más de casos agudos (242) que de casos crónicos (218). De los casos agudos tratados, 233 corresponden a personas infectadas por vía oral. Los pacientes de los brotes orales no están incluidos en los casos diagnosticados en la Consulta Externa. El número de casos crónicos tratados contrasta con el número de diagnosticados siendo su rango de 12 a 40 pacientes por año en los diez años revisados. Estas cifras corresponden parcialmente al número de pacientes diagnosticados menores de 50 años a quienes convocamos de manera insistente para administrarles tratamiento anti-parasitario. Los pacientes con infección confirmada por T. cruzi mayores de 50 años, generalmente ya han progresado a Kuschnir II o III y no reciben tratamiento. No obstante, evaluamos las condiciones del paciente y los beneficios. En otras palabras, la frecuencia del diagnóstico de la ECh es más numerosa en pacientes mayores cuando ya es muy poco o ninguno, el beneficio del tratamiento anti-parasitario.
Nuestro agradecimiento a los Profesores Alexis Mendoza y Consuelo Ramos quienes ofrecieron un volumen completo de esta revista a fin de compilar nuestros artículos, a propósito del aniversario 70 de la fundación del Instituto de Medicina Tropical. A José Jesús Cubillán por la revisión del manuscrito.