INTRODUCCIÓN: La toxocariasis es una zoonosis prevalente en muchas regiones tropicales y subtropicales. En Venezuela existe un número relativamente bajo de investigaciones, pese a su alta frecuencia, cuando es buscada. En este estudio se revisó el comportamiento en 6 años de los pacientes atendidos en el Instituto de Medicina Tropical (IMT) para esta patología. MÉTODOS: Se realizó un estudio observacional, en el período 2011-2016, evaluando los diagnósticos y las principales características de los casos atendidos con toxocariasis en el IMT, por técnicas inmunológicas como ELISA, Western-bloty ELISA-Avidez-IgG. RESULTADOS: Se atendieron 2.750 casos (408 casos por año ±184); 69,5% correspondieron a toxocariasis visceral. La edad promedio de los pacientes fue 20,43 años (IC95% 19,5-21,27), 54,9% del género masculino; 51,47% refirió la posesión de mascotas, 40,46% eran del Distrito Capital (resto de los 24 estados). Del total, 53,02% fueron positivos por ELISA, en estos la mediana de Avidez de anticuerpos IgG anti-Toxocara fue de 86%. En cuanto a la eosinofilia, los valores promedios fueron de 22,6% (IC95% 21,1-24,1%), mayores en aquellos con ELISA positiva (promedio 23,9%) (p=0,0268), también significativamente mayores en pacientes con toxocariasis visceral (22,9%) (p=0,0364). DISCUSIÓN: La toxocariasis sigue siendo un importante problema de salud pública que requiere mayor estudio y evaluación, ejemplo estudios trasversales y prospectivos para precisar mejor su comportamiento epidemiológico, así como en el conocimiento de su impacto clínico. El desarrollo de mejores técnicas de diagnóstico, y en particular de biología molecular, son una clara necesidad en Venezuela y otros países de la región.
Palabras clave: toxocariasis; Toxocara canis; Toxocara cati; epidemiología; inmunodiagnóstico; Venezuela.
INTRODUCTION: Toxocariasis is a zoonosis, prevalent in many tropical and subtropical regions. In Venezuela, there are a relatively low number of investigations, despite its high frequency, when it is sought. For these reasons we reviewed the trends and features in 6 years, of the patients attended in the Tropical Medicine Institute for this pathology. METHODS: An observational study was carried out in the period 2011-2016, evaluating the diagnoses and main characteristics of the cases treated with toxocariasis in IMT, using immunological techniques such as ELISA, Western-blot and ELISA-avidity-IgG. RESULTS: 2,750 cases were attended (408 cases per year ± 184); 69.5% were visceral toxocariasis. The mean age of the patients was 20.43 years (95% CI 19.5-21.27), 54.9% of the male gender; 51.47% referred to the possession of pets, 40.46% were from the Capital District (rest of the 24 states). Of the total, 53.02% were positive by ELISA, in these, the median avidity of anti-Toxocara IgG antibodies was 86%. As for eosinophilia, the mean values were 22.6% (CI95% 21.1-24.1%), higher in those with positive ELISA (mean 23.9%) (p=0.0268), as well significantly higher in patients with visceral toxocariasis (22.9%) (p=0.0364). DISCUSSION: Toxocariasis remains a major public health problem, requiring further study and evaluation. Cross-sectional and prospective studies are needed to better define its epidemiological behavior, as well as its clinical impact. The development of better diagnostic techniques and molecular biology in particular, is a clear need in Venezuela and other countries in the region.
Key words: toxocariasis; Toxocara canis; Toxocara cati; epidemiology; inmunodiagnosis; Venezuela.
La toxocariasis continúa siendo un importante problema de salud pública en muchos países, incluida Venezuela1-4. Esta zoonosis tiene múltiples implicaciones epidemiológicas5-11, así como clínicas12-17, por lo cual cobra gran importancia una mayor investigación de la misma. Sin embargo, aún el número de estudios publicados en el país, así como en otros de América Latina, es limitado18. También es importante mencionar que se requiere mejorar la disponibilidad de técnicas de diagnóstico inmunológico y molecular que permitan una mejor identificación de los casos1,2,4,19, especialmente aquellos que pueden considerarse agudos y que ameritan tratamiento para evitar las múltiples consecuencias, que tanto la toxocariasis visceral como la ocular pueden tener20,21.
Los estudios transversales de seroprevalencia, fundamentalmente basados en pruebas como la ELISA, han encontrado en América Latina una variación de 1 a 67%3,22. En el caso de Venezuela, en el mismo rango, donde además de la prevalencia de infección en perros, se ha encontrado alrededor de 12% y 65% en suelos en algunos lugares3,22.
La mayoría de los estudios de toxocariasis en América Latina están basados en pequeñas muestras, poco representativas, y fundamentalmente limitadas a lugares puntuales, en tiempo y espacio3,22. Por estas razones, el presente estudio, caracteriza el comportamiento de la toxocariasis en más de 2.750 casos evaluados en un período de 6 años, con pacientes procedentes de todo el territorio nacional, mostrando la importancia de esta zoonosis parasitaria y de su alta prevalencia.
Se realizó un estudio observacional sobre la base de sujetos atendidos en el Instituto de Medicina Tropical en el período 2011-2016 (para el año 2016 solo se presentan resultados obtenidos durante el período enero-marzo), con una muestra no aleatoria, en la Sección de Inmunoparasitología, procedentes de diferentes lugares de Venezuela.
Todos los participantes fueron entrevistados para determinar la presencia de factores asociados a la infección (como tenencia de mascotas) y se realizó examen clínico general. Asimismo, se obtuvo una muestra de sangre de cada individuo, para la obtención de suero (para ELISA y ELISA-Avidez-Ig G) y con anticoagulante para realizar el contaje relativo de eosinófilos (%).
Las muestras de suero fueron procesadas mediante la técnica de ELISA para detectar anticuerpos específicos contra Toxocara, mediante el método estandarizado en el IMT en estudios previos.
Los resultados fueron almacenados en una base de datos elaborada con la hoja de cálculo Excel y el análisis estadístico se realizó con el paquete estadístico Stata v.14.0 ® (licenciado para la UTP). Las variables cuantitativas se resumieron como promedios, con desviaciones estándar y/o intervalos de confianza del 95% (IC95%). Se analizaron frecuencias absolutas y relativas (con rangos intercuartiles para dispersión), se buscaron diferencias en la distribución de individuos en cada factor estudiado, tanto clínico como epidemiológico, con respecto al resultado de la prueba inmunológica; estas diferencias fueron verificadas mediante la prueba de X2 y t de Student, luego de verificar supuestos (normalidad con la prueba de Shapiro-Wilks), con un nivel de confianza de 95%, p significativa <0,05.
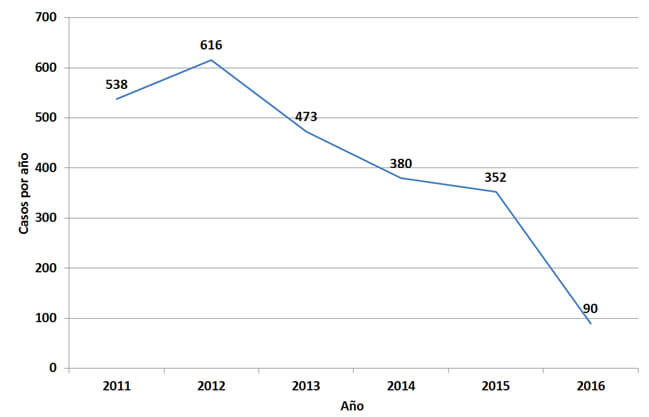
Durante el período de estudio (6 años) se atendieron un total de 2.750 casos evaluados inmunológicamente, para un promedio de 408 casos por año (±184/año, mínimo 90 en 2016, máximo 616 en 2012) (Figura 1). Del total de casos, 69,5% correspondieron a toxocariasis visceral y 30,5% a toxocariasis ocular.
La edad promedio de los pacientes fue 20,43 años (IC95% 19,5-21,27), siendo mayores las pacientes del género femenino, 22,5 años (IC95% 21,2-23,8) que las de pacientes del género masculino, 18,8 años (IC95% 17,6-20,0) (p=0,0001). En cuanto al género, 54,9% correspondió al género masculino y 45,1% al femenino. Del total de casos, 51% correspondió a menores de 10 años de edad (Figura 2).
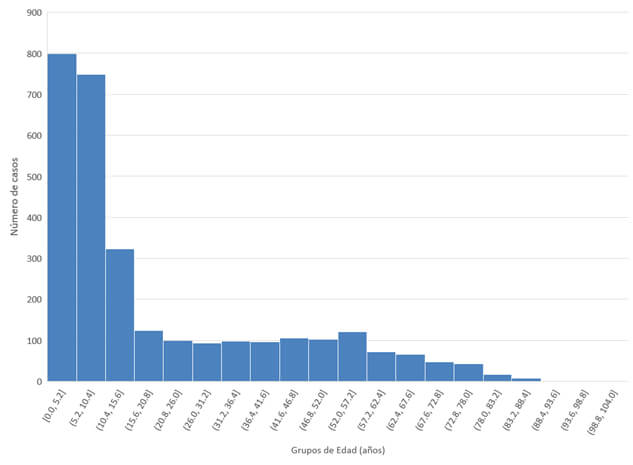
Los casos de toxocariasis visceral ocurrieron en pacientes de edad promedio 16,74 años (IC95% 15,817,7), en tanto los de toxocariasis ocular con edad promedio 28,7 años (IC95% 27,2-30,2) (p<0,0001).
De los pacientes, en 51,47% refirió la posesión de mascotas (48,53% no). Sin diferencias significativas según fuese toxocariasis visceral o toxocariasis ocular (p=0,537).
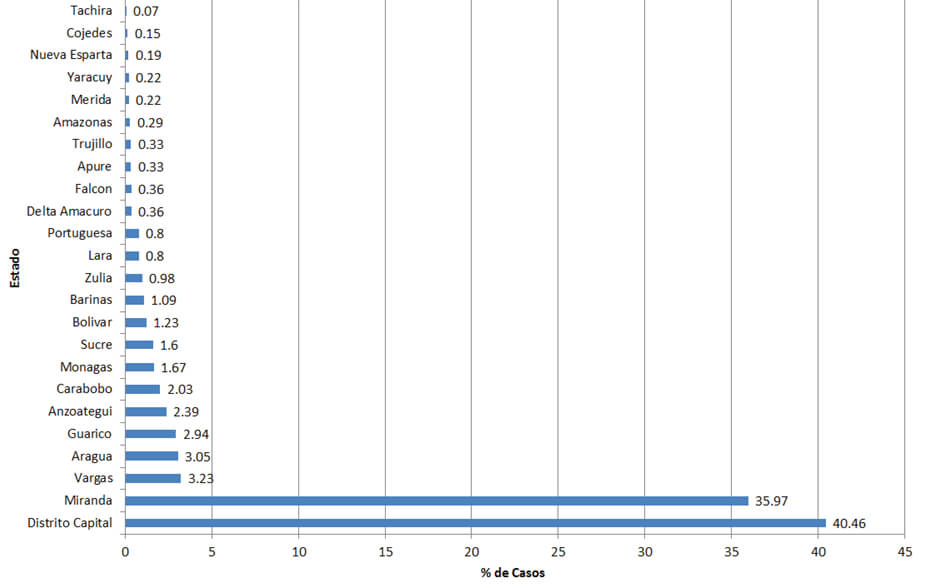
En cuanto a la procedencia 40,46% eran del Distrito Capital, seguidos por 35,9% del estado Miranda, seguidos por otros estados (Figura 3), en total 24 estados. También se identificaron 2 casos importados, uno de Colombia y otro de Perú (países donde la toxocariasis es una patología presente también).
Del total de pacientes evaluados, 53,02% fueron positivos por ELISA para anticuerpos anti-Toxocara. En los casos positivos por ELISA, la mediana de Avidez de anticuerpos IgG anti-Toxocara fue de 86% (rango intercuartil 62-100), correspondiendo 82,6% a un valor >50%, 11,6% a 30-50% y 5,8% a valores <30%.
En cuanto a la eosinofilia, los valores promedios fueron de 22,6% (IC95% 21,1-24,1%), mayores en aquellos con ELISA positiva (promedio 23,9%) en comparación con ELISA negativa (promedio 20,8%) (p=0,0268). De igual forma, siendo significativamente mayores en pacientes con toxocariasis visceral (22,9%) en comparación con aquellos con toxocariasis ocular (14,4%) (p=0,0364).
La toxocariasis continúa siendo un importante problema de salud pública23-26. Como agente causal del síndrome de larva migrans visceral y del síndrome de larva migrans ocular18,21,27,28, Toxocara canisy Toxocara cati, producen un amplio espectro clínico que aún precisa ser mejor clarificado. Esta infección zoonótica representa un considerable reto diagnóstico para el clínico y en tal sentido, las técnicas de diagnóstico inmunológico proveen en los actuales momentos el único medio para poder identificar casos especialmente agudos y crónicos4, 29-32.
El presente estudio representa un importante esfuerzo en cuanto al número de casos incluidos, más de 2500 evaluados inmunológicamente durante 6 años en el principal centro de referencia para el diagnóstico de esta patología en el país. Consistente con lo reportado en la literatura científica internacional, la edad promedio de los casos en este trabajo, estuvo por debajo de 21 años de edad, siendo más de la mitad de los casos menores de 10 años21,33.
En el Instituto de Medicina Tropical se pudo llevar a cabo el diagnóstico a través de ELISA así como, Western-blot y de la técnica de avidez de anticuerpos IgG1, 2. De acuerdo con las características clínicas y de laboratorio de la infección, los valores promedios de eosinofilia estuvieron alrededor del 22%, siendo significativamente mayores en aquellos que fueron ELISA positivos2,33. Es de notar que el número de casos atendidos en el tiempo ha disminuido considerablemente desde el año 2011 y 2012 hasta el año 2015. Finalmente, es de destacar los resultados, que a pesar de corresponder más del 40% de los casos a pacientes que proceden del Distrito Capital, existe una amplia variedad de procedencias de prácticamente todos los estados en el territorio nacional1-3,34-41.
Para la toxocariasis, existe actualmente un importante esfuerzo en incrementar las técnicas serológicas para la detección de anticuerpos anti-Toxocara canis1,3,4,19,20,22,35,42, que se basen en antígenos de excreción y secreción (TES) con ELISA y Western-blot (Cuadro 1), entre otros21.
En este contexto existe una clara necesidad de incrementar los estudios serológicos tanto en Venezuela, como en otros países de la región donde revisiones recientes indican que existe una carencia de datos que permitan estimar con mayor precisión la seroprevalencia en humanos así como la prevalencia en suelos y en animales1,3,4,18,21,22,34,38,39.

Se requiere desarrollar consensos para el diagnóstico de la toxocariasis en humanos4, seguir mejorando la disponibilidad de pruebas diagnósticas y precisar en cuanto al espectro de manifestaciones clínicas1,3,19,20, no solamente aquellos de presentación visceral sino también de presentación ocular y finalmente continuar en el desarrollo de nuevas opciones terapéuticas para el tratamiento22,35,42. Como se ha venido adelantando en años recientes, es importante también mencionar a la luz de estos resultados y dado al gran volumen de casos reportados en 6 años que se necesita incrementar el conocimiento por parte del personal de salud sobre esta enfermedad. Estudios recientes han reportado que menos de la mitad de los especialistas conocen correctamente cómo hacer el diagnóstico clínico y de laboratorio de esta patología43.
La toxocariasis puede considerarse una patología desatendida y como tal deben profundizarse los estudios a nivel epidemiológico, clínico, terapéutico y también preventivo. A nivel diagnóstico, particularmente la biología molecular, con el uso de la PCR 44-59, para la identificación de las infecciones por Toxocara, son una clara necesidad en Venezuela y otros países de la región.