La tripanosomiasis americana o enfermedad de Chagas es una zoonosis, causada por el Trypanosoma cruzi, que ocurre entre mamíferos, incluyendo al hombre e insectos triatominos, vectores del parásito, constituyendo un problema de salud pública con 10 millones de personas infectadas y 90 millones en riesgo para el Continente Americano. Los componentes primarios de esta zoonosis sean parasito, hospedador mamífero y vectores, pueden ser equivalentes a los vértices de un triángulo equilátero, en el cual los ángulos son iguales y con la misma contribución al total. Sin embargo, herramientas parasitológicas, morfológicas y moleculares han permitido analizar los complejos eco-patogénicos de la tripanosomosis americana en cada uno de los cuales, los vértices del triángulo descrito no tienen la misma contribución. En un determinado complejo puede ocurrir que los insectos vectores sean los determinantes cruciales de la parasitosis, bien por la adaptación al corredor peridomicilio- domicilio, la ocupación de nichos vegetales, o por cambios en el uso de la oferta alimentaria, procesos que se van fijando genéticamente. Otro tanto viene dado por las diferentes subpoblaciones T. cruzi las cuales pueden presentarse con manifestaciones clínico epidemiológicas exclusivas y condicionantes de los ciclos de transmisión. Finalmente, el mamífero puede ser preponderante como un potencial selector de algunas las subpoblaciones del parasito, en un escenario de variabilidad, virulencia y paninfectvidad, que trasciende los paradigmas de los mecanismos de transmisión. Así cada vértice de este triángulo hipotético que conforma a la parasitosis, modifica sus dimensiones angulares con respecto a los otros dos en función de la preponderancia del vector, del parásito o del reservorio mamífero en determinados ecosistemas, pasando de un triángulo equilátero a uno escaleno o quizás a otras figuras de mayor complejidad.
Palabras clave: tripanosomiasis, enfermedad de Chagas, Venezuela.
American trypanosomiasis or Chagas disease is a zoonotic disease, caused by Trypanosoma cruzi, which occurs between mammals including man and triatomine bugs that act as vectors of the parasite. It constitutes a public health problem with 10 million of infected people and 90 million at risk for America. The primary components of this zoonosis are parasite, mammalian host and insect vectors, which can be matched to the vertices of an equilateral triangle, with equal angles and the same contribution for each to the total. However, parasitological, morphological and molecular tools have allowed us to analyze the eco pathogenic complex constituted by the elements for T. cruzi transmission with no equal contribution in its vertices. In some cases, insect vectors may be the crucial determinants of parasitoses, due to their adaptation to peridomestic-domestic corridor, occupation of vegetables niches or changes in use of the food supply, processes that are genetically setting. The same occurs with the different parasite subpopulations with a particular epidemiological clinical performance and role in transmission cycles. The mammal acts as a selector of parasite genotypes, in a scenario of changing variability, virulence and paninfectivity. Altogether these facts challenge the actual transmission paradigms meaning that each change in the angle dimensions, relative to the other two, modifies all of them transforming the equilateral triangle into a scalene triangle, or one more complex figure.
Key words: trypanosomiasis, Chagas disease, Venezuela.
Universidad Central de Venezuela, Instituto de Zoología Tropical y Ecología, Facultad de Ciencias. Venezuela.
[email protected]
La tripanosomiasis americana (TA) o enfermedad de Chagas (Ech) es una parasitosis heteroxénica cuyo agente etiológico es el Trypanosoma (Schizotrypanum) cruzi (Eucarya, Excavata, Kinetoplastea), el cual se desarrolla entre hospedadores mamíferos de hasta nueve géneros incluyendo al hombre y hospedadores invertebrados, específicamente triatominos (Hemiptera, Reduviidae, Triatominae) que hacen las veces de vector.
Esta parasitosis constituye en el continente americano un problema de salud pública con alrededor de 10 millones de personas infectadas y 90 millones en riesgo (WHO, 2016).
En el afán como Homo sapiens de definir, ubicar, separar y clasificar podríamos equiparar a esta zoonosis en una visión general, a un triángulo equilátero en el cual los ángulos que separan a los tres vértices componentes como son parasito, hospedador- mamífero y vectores, parecen ser iguales y con la misma contribución en magnitud del todo. Sin embargo, al utilizar herramientas parasitológicas, morfológicas, moleculares y eco epidemiológicas para abordar los diferentes complejos eco patogénicos de la zoonosis, nos adentramos en cada uno de estos vértices y evidenciamos casos en los cuales la contribución de cada componente no es igual, desfigurando la geometría del triángulo.
Las enzootias están restringidas primariamente a animales silvestres, en condiciones zoogeográficas particulares, constituyendo lo que Pavlosky (1966) denomino “nidalidad de las parasitosis”.
El hombre afecta los ecosistemas cuando coloniza áreas deshabitadas o poco intervenidas, ejerciendo fuerzas selectivas que conllevan a la derivación de algunas parasitosis desde las enzootias hasta las zoonosis. En este proceso, hombre, animales silvestres, animales sinantrópicos y/o domésticos, forman parte de la cadena de transmisión de los agentes patógenos, más con un rol distinto.
Muchos son los factores, determinantes de las zoonosis que han sido descritos (Pinto-Dias, 2000; Walter, 2003; Morse, 2004) a saber:
La exploración de los recursos naturales; los cambios ecológicos debido al uso de la tierra como medio de subsistencia y propiedad, incluyendo las áreas de reserva de biodiversidad;los modos de producción económica de la población humana, incluyendo la industrialización y tecnificación; la urbanización y construcción como proceso social, las actividades de placer y uso del tiempo libre (deportes, caza, etc.) sobre áreas de biodiversidad; el comportamiento demográfico incluyendo los viajes y las migraciones; el manejo social y/o individual de la zoonosis, estimado como la actitud frente a las enfermedades, el manejo del riesgo o la interrupción de los programas de seguimiento y control sanitario.
Algunas zoonosis son focales o nidales con focos silvestres en los cuales circulan agentes patógenos en imbricación ecológica con sus hospedadores, en áreas de poca amplitud geográfica. El clima, el relieve, el suelo, la fauna y la flora, condicionan estas asociaciones simbióticas, cuya presencia en principio silenciosa, pudiese conducir a un desarrollo potencial de enfermedad (Pavlovsky, 1966).
Mientras mejor se comprenda el papel de los reservorios, hospedadores intermediarios o incidentales y vectores, mejor se podrá determinar las características de los focos naturales y los riesgos que existen de transmisión de las parasitosis al humano y sus animales domésticos (Pífano, 1960; Pavlovsky, 1966; Herrera, 2014).
La TA o Ech, se enmarca en el escenario descrito, en el cual los ecótopos primarios de circulación del T. cruzi constituyen ambientes cerrados o semiabiertos con una proporción de hospedadores y vectores condicionada por la disponibilidad de recursos energéticos.
Algunos de estos paisajes van desde parajes semidesérticos de Centro y Sur América, pasando por el altiplano andino, los bosques de América del Sur, áreas litoraleñas con cadenas montañosas, áreas de selva Amazónica, hasta el complejo de pampascatingas y mesetas (Pinto-Dias, 2000, Herrera, et al., 2005a).
La TA se puede transformar en una zoonosis, cuando el hombre ocupa el medio natural, alterando la ecología de los hospedadores mamíferos e insectos vectores (Herrera, 2014; Figura 1), favoreciendo su dispersión hacia el ambiente humano, mediante procesos como:
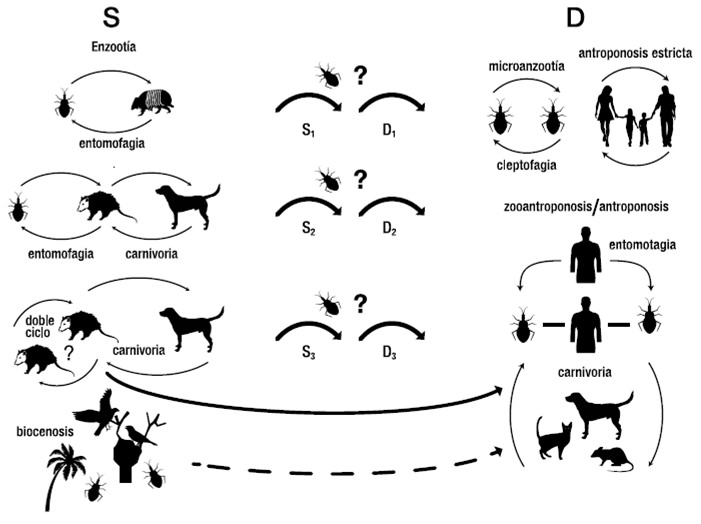
La visita temporal de insectos vectores y reservorios silvestres a la vivienda humana, atraídos por la luz o fuentes de alimentos, sin que necesariamente exista colonización de la vivienda; la colonización del hábitat humano por triatominos infectados, en paralelo a la existencia de nichos naturales independientes, diseminados pasivamente por el hombre, favoreciendo el establecimiento temporal o definitivo de los vectores; el establecimiento definitivo de animales silvestres en hábitats domésticos y la salida de los domésticos hacia ambientes silvestre a través de corredores de la parasitosis; la derivación de procesos zoonóticos hacia las antroponosis estrictas, cuando más allá de las interacciones vectores y mamíferosparásitos, se da un paso de parásitos humanoshumanos por vías verticales u horizontales.
T. cruzi es de naturaleza clonal, constituido por un conjunto heterogéneo de subpoblaciones, distribuidas en un área geográfica, las cuales muestran alta diversidad en su comportamiento biológico, condicionando asi la resolución de la parasitosis.
La evolución de dos grandes subpoblaciones de T. cruzi (TcI y TcII) empezó 150 millones de años atrás, con la separación geográfica entre Laurasia (formando lo que hoy día seria Norte América) y Gondwanaland (formando lo que hoy día seria Sur América), asociada a la dispersión de los mamíferos ancestrales tales como marsupiales, Edentata y ungulados (Sur América) y placentados tales como carnívoros, insectívoros y roedores (Norte América y África), los cuales actuaron como reservorios de TcI y TcII respectivamente (Briones et al., 1999) . Para otros autores los roedores caviomorfos y primates (infectados con TcII), se desplazaron de África hacia Norte América, con ingreso secundario esporádico a Sur América (37 Ma), en tanto los marsupiales (infectados con TcI) se distribuyeron en Sur América (Briones et al., 1999; Zingales, 2011).
Con la formación del istmo de Panamá (ocurrida ente 2 a 5 Ma atrás) se dio el gran intercambio de mamíferos y genotipos del parásito, entre Norte y Suramérica. Tradicionalmente TcI se relacionó con el ciclo de transmisión silvestre, por su originaria asociación con los marsupiales, mientras que TcII se relacionó con el ciclo de transmisión doméstico, asociado a placentados y primates. Sin embargo, estas relaciones entre genotipos y mastofauna constituye un punto de discusión, aun no resuelto (Zingales, 2011).
A través del uso de herramientas bioquímicas, moleculares y biológicas, se ha establecido que T. cruzi, está conformado por unidades discretas de tipificación genética (“Discrete Typing Unit” o DTUs), de alta diversidad biológica (Zingales et al., 2009; 2012) a saber:
T. cruzi I (TcI, Z1 ó DTU1): grupo más antiguo y homogéneo, asociado principalmente con ecotopos silvestres, sinantrópicos, y mamíferos didelfidos, desde la cuenca amazónica hacia el norte de Suramérica y Centro América;
T. cruzi II (TcIIb, Z2 ó DTU2b): subpoblación heterogénea, distribuida principalmente en el Cono Sur, asociado al ciclo doméstico y animales, desdentados, roedores, carnívoros y primates;
T. cruzi III (TcIIc, Z3/Z1 ó DTU2c): asociada principalmente con la transmisión enzoótica, mamíferos terrestres y cavadores y presente en casos de infección humana;
T. cruzi IV (TcIIa, Z3 ó DTU2a): asociado a enzootias y canidos silvestres, ocasionalmente presente en infecciones humanas;
T. cruzi V (TcIId, Cepa Boliviana Z2, ó DTU2d): asociado a ciclos de transmisión domésticos, hospedadores humanos y triatominos del Cono Sur;
T. cruzi VI (TcIId, Cepa Paraguaya Z2 ó DTU2e): asociado a triatominos domiciliados del cono Sur.
Estudios entre los que se suman los de nuestro grupo de investigación, han trascendido paradigmas en cuanto a la exclusividad de algunos genotipos o subpoblaciones del parasito a un área geográfica y/o a determinados hospedadores o vectores, con un tipo de resolución clínica de la parasitosis en el humano (Herrera, et al., 2004).
El estudio de los aislados venezolanos ha revelado la presencia de tres DTU (TcI, TcIII y TcIV) en diferentes áreas geográficas de Venezuela, con predominancia de TcI, el genotipo más frecuente al norte de la cuenca amazónica.
Un hallazgo ha sido la ocurrencia de TcIV entre casos humanos de Ech en Venezuela, en el vector Rhodnius prolixus en los llanos venezolanos y en Panstrongylus geniculatus del estado Vargas, este último en áreas de brotes de transmisión oral de Ech (Carrasco, et al. 2012; Figura 2).
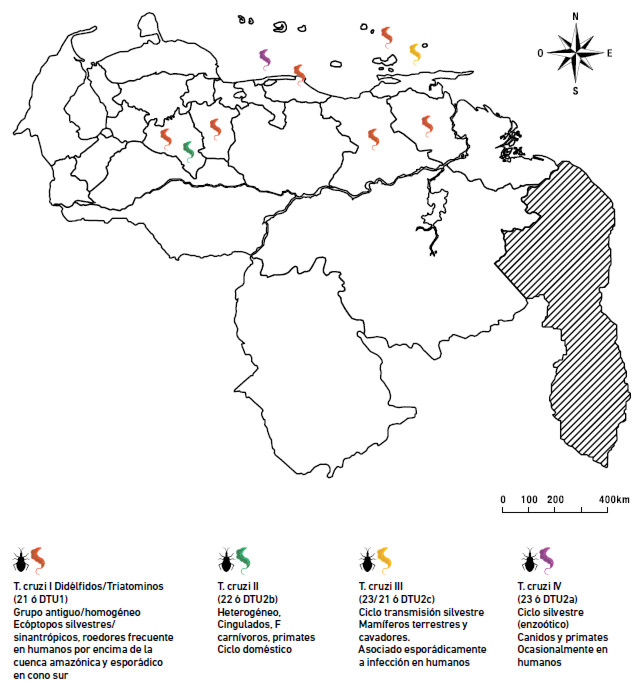
Estudios más recientes sobre la TA como zoonosis en el estado Nueva Esparta, el estado Anzoátegui y el Estado Monagas (áreas no endémicas), revelaron la presencia de TcIII en el noreste de Venezuela, mediante el uso de PCR–RFLP en aislados obtenidos en focos zoonóticos, con la participación de P. geniculatus como vector y Dasypus novemcinctus (cachicamo o armadillo) como reservorio. Estos hallazgos refuerzan la idea de la existencia de una asociación evolutiva ancestral entre este genotipo y el armadillo, mamífero cuya sangre es de uso medicinal casero y su carne de alimentación por la población humana venezolana, lo cual resulta un riego de infección. La presencia de estos focos nidales potencialmente zoonóticos en áreas rurales, algunas de ellas de uso turístico, disipara las alarmas frente a brotes de Ech (Llewellyn et al.; Morocoima et al., 2015, Figura 2).
En un determinado complejo zoonótico, los insectos vectores pueden ser los determinantes cruciales de la parasitosis, sea por la adaptación al corredor peridomicilio- domicilio, por la ocupación de nichos vegetales o biocenososis cercanas a la vivienda, o por el cambio en el uso de la oferta alimentaria de la que disponen; algunos de estos roles se van seleccionando inclusive hasta el nivel genético, provocando cambios en los vértices del triángulo de transmisión.
Los vectores del T. cruzi, están conformados por 31 subfamilias de insectos; la mayoría de ellos hematófagos estrictas. Estos insectos tienen gran capacidad de domiciliación cuando existen las condiciones micro climáticas y de nicho que aseguran su reproducción. Así actúan como vectores de T. cruzi y favorecen su circulación en ambientes sinantrópicos y el tránsito entre enzootia, zoonosis y antropozoonosis (Cazorla-Perfetti y Nieves-Blanco, 2010).
En Venezuela la presencia y amplia distribución del Rhodnius prolixus, considerado hasta ahora vector principal de la Ech, constituye un factor de riesgo para el mantenimiento de la TA; sin embargo la invasión de la vivienda humana por otras especies de vectores tradicionalmente peridomésticos (T. maculata) y silvestres (P. geniculatus), refleja los cambios que ocurren por factores antropogénicos tales como la disminución de la población de vertebrados como fuente de alimentación, lo cual favorece el desplazamiento de los vectores (Feliciangeli et al., 2004; Añez et al., 2004; Morocoima et al., 2010a,b).
En nuestros estudios hemos registrado la presencia de T. cruzi por métodos parasitológicos y moleculares en R. prolixus, P. geniculatus y Triatoma maculata, en toda el área de los llanos altos occidentales, llanos centrales, región centro Costera y nororiente del País. La mayoría de los aislados corresponden al genotipo TcI; muy esporádicamente P. geniculatuas aparece como vector de TCII y T. maculata, como vector de TcIV. (Carrasco et al., .2012, Morocoima et al., 2010a, Morocoima et al, datos no publicados, Figura 2).
La variabilidad en cuanto a las subpoblaciones de T. cruzi que circulan en los triatominos de los ecosistemas venezolanos, ha sido mayor en relación a la de aislados de mamíferos, quizás porque el insecto vector actúa como e jeringa biológica y con ello se favorece la dispersión entre los ecosistemas silvestres, peridomésticos y domésticos.
En otros estudios hemos registrado la presencia de Psammolestes arthuri, Eratyrus mucronatus, Eratyrus. cuspidatus, Rhodnius pictipes y Panstrongylus rufotuberculatus (todos escasamente referidos en la literatura) naturalmente infectados con T. cruzi en el peridomicilio y domicilio, ratificando su rol potencial en el ciclo de transmisión (Morocoima y col., 2010b, Morocoima et al., 2011; Carrasco et al., 2012; Cruz-Guzmán et al., 2014; Lozano-Arias et al., datos no publicados).
En modelos de laboratorio hemos observado que los aislados de triatominos de origen venezolano, independientemente de la especie involucrada, muestran un alto potencial de transmisibilidad, ya que permanecen circulando en sangre por mucho tiempo y en alto número, constituyendo una fuente “siempre” disponible de parásitos (Lozano-Arias, et al., datos no publicados).
Es necesario ampliar la investigación a nivel entomológico y epidemiológico, sobre estas especies triatominos no consideradas de importancia primaria para esclarecer su reciente incidencia en el ciclo de transmisión de la parasitosis en Venezuela.
Algunas especies consideradas otrora silvestres restrictas a palmeras, nidos de aves o cuevas de mamíferos, están adaptándose al domicilio, este proceso de domiciliación se ha ido fijando genéticamente. Específicamente, el análisis fenotípico de T. maculata obtenido de los Estados de Anzoátegui, Bolívar, Portuguesa, Monagas, Nueva Esparta y Sucre, en Venezuela, ha permitido evidenciar reducciones significativas en el tamaño del ala y otras variaciones que pudiesen afectar el vuelo de ejemplares peridomésticos y domésticos (García -Alzate et al., 2014).
Estos hallazgos se fundamentaron en estudios de variabilidad genotípica mediante análisis de secuencias in silico y de secuencia de productos de PCRRFLP han demostrado polimorfismo en insectos vectores del domicilio en comparación con los otros hábitats (García - Alzate et al., 2014;)
En triatominos de cría en laboratorio, conformado por poblaciones endogámicas entrecruzadas sin reposición de pool génico, se ha intentado recrear una analogía de las condiciones de domiciliación. Estudios realizados en estas poblaciones de laboratorio han mostrado un potencial crecimiento alométrico y disminución del dimorfismo sexual y perdidas de puntos anatómicos, relacionados con el vuelo en triatominos de cría que han formado poblaciones endogámicas entrecruzadas. Estos modelos nos han permitido emular las condiciones de domiciliación, en ambientes cerrados, con alta protección de predadores y alta disponibilidad de fuente sanguínea otorgada a través de la sangre de humanos y animales domésticos (Pérez- Roche, datos no publicados)
Lo expuesto, indicaría como la presión ambiental es gran selectora de genes que conllevan a diferenciación en el comportamiento y la fisiología de los vectores; afectando la cadena de transmisión.
La presencia de T. cruzi en varios ordenes de mamíferos tales como Didelphidomorphia, Lagomorpha, Chiroptera, Rodentia, Pilosa, Cingulata, Carnivora, Primates, Perisodactyla y Artiodactyla, evidencia el eclecticismo del parasito en cuanto a su distribución entre numerosos hospedadores mamíferos, que pudiesen actuar como reservorios, condicionados por su biología, densidad poblacional, simpatría con triatominos y distribución geográfica ente otros (Acosta y López, 2013; Herrera., 2010a; 2014).
El género Didelphis ha sido considerado en algunos ecosistemas un reservorio primario, por su alta incidencia de infección y la presencia de un doble ciclo de transmisión, el más frecuente el sistémico y el menos frecuente el que se presenta en las glándulas anales. De estas glándulas se liberan tripomastigotes metacíclicos infectantes, con potencial para contaminar alimentos y enseres favoreciéndose la transmisión oral (Herrera y Urdaneta Morales, 1991; Urdaneta-Morales y Nironi, 1996).
Estos mamíferos omnívoros, prolíficos y sinantrópicos, ocupan varios nichos, lo que hace más frecuente presencia en trama de transmisión y en corredores biológicos entre lo silvestre y lo domestico (Díaz-Bello, et al., 2016). Hasta los momentos los didelfideos estudiados por nosotros, han sido reservorios del genotipo TcI. Estos resultados coinciden con lo reportado por otros autores para esta especie (Añez et al, 2009; Carrasco et al, 2012).
Mamíferos como el armadillo o cachicamo (Dasypus novemcinctus) y otras especies cinegéticas como el venado (Odocoileus margaritae), el báquiro (Pecari. tajacu), o el chigüire (Hydrochoerus hydrochaeris) poco descritas como portadoras de T. cruzi en el país, han sido encontradas infectadas en nuestros estudios, (Carrasco et al., 2012; Herrera., 2014; Ferrer et al, datos no publicados), lo cual expande el horizonte en aspectos relativos al manejo y consumo de estos mamíferos por el hombre y su rol en la zoonosis
Los aislados provenientes de estos mamíferos descritos, presentaron en el modelo murino un comportamiento biológico similar al de reservorios de asociación tan antigua como los didelfidos, con largos periodos de baja infección, bajas y continua carga parasitaria y portadores en su mayoría del genotipo TcI, mas con variabilidad dentro de este genotipo (Rivera y col., 2015; Figura 3).
Patrones biológicos como los descritos, garantizarían una amplia disponibilidad de parásitos en el tiempo y de posibles reservorios, en un sistema dinámico para cada región geográfica. El registro de subpoblaciones del parasito poco conocidas, como es la presencia de TcIII en cachicamos de la región oriental venezolana abre límites a nuevas manifestaciones clínicas y epidemiológicas de la parasitosis (Herrera, 2010b; Carrasco et al., 2012; Lozano- Arias et al, datos no publicados).
Otro aspecto importante de la interacción parásito-hospedador mamífero, es el parasitismo tisular, condicionante para la resolución de la parasitosis hacia la enfermedad.
Con la observación de portadores asintomáticos de ciertos microorganismos patógenos se ha venido manejando la noción de que el parasitismo es una condición necesaria, pero no suficiente, para que se manifieste la enfermedad. Algunas de los elementos determinantes pudiesen ser la condición inmunológica, o condiciones multifactoriales altamente condicionadas por la genética, en la cual la acción patógena se mide como una probabilidad más (Andrade, 2000).
Los aislados venezolanos, modelados en animales de laboratorio, muestran gran variabilidad en intensidad y eclecticismo en el parasitismo tisular, siendo el miotropismo lo más frecuente, con mayor intensidad de invasión. Tejidos tales como cerebro, bazo, hígado, riñón, pulmón, páncreas presentan en la mayoría de los casos un parasitismo de escaso a moderado. Este amplio espectro en el parasitismo tisular refrenda la capacidad paninfectiva de los aislados, abriendo la posibilidad de que la parasitosis tenga otras manifestaciones adicionales a la miocardiopatía chagásica, tales como alteraciones neumológicas, hepáticas o bien encefalitis de origen chagásico (Scorza et al., 1996; Morocoima et al., 2015).
Otro hallazgo interesante es la presencia de parásitos en órganos luminales como vejiga urinaria, útero, sistemas genitales, lo cual expande la discusión a nuevos mecanismos de transmisión debido a la salida de estadios infectivos a través de las rutas luminales (Scorza et al., 1996; Herrera y Urdaneta- Morales, 2003; Herrera et al., 2005; Cruz-Guzmán et al, 2014).
Estos resultados redimensionan la interacción parasito-hospedador mamífero y como ella se manifiesta especialmente en cuanto al parasitismo tisular, abriendo el análisis de esta parasitosis hacia procesos epidemiológicos y patológicos no establecidos totalmente.
Trypanosoma cruzi es el agente causal de una de las zoonosis más importantes en América Latina, con características muy variadas de la parasitosis que reflejan una gran diversidad genética, representada por al menos seis unidades discretas de variación genética de las subpoblaciones del parasito (DTUs).
Estudios multidisciplinarios permiten decir que en las zoonosis, en particular la TA o Ech, cada ecosistema pareciera ser único y dinámico en espacio y tiempo, con la presión ambiental como gran selectora.
algunos ecosistemas presentes, o relictos de ecosistemas pasados que aún se mantienen como vestigios de condiciones climáticas y ecológicas, se podría conocer cual elemento de esta triada del sistema parasitario prevalece en esta historia natural.
Podemos modelar para comprender la parasitosis en la triada constituida por vector, parasito y mamífero reservorio, partiendo del supuesto que los tres componentes tienen igual participación en el ciclo de transmisión (triángulo equilátero). La preponderancia de cada elemento puede variar dependiendo de factores, biológicos, ecológicos y epidemiológicos (transición del triángulo equilátero al escaleno) desmitificando algunos paradigmas.