El virus Zika (VZIK) es un flavivirus transmitido a humanos por mosquitos del género Aedes. Este virus fue introducido a América del Sur en 2014, generando una nueva epidemia por arbovirus de inesperada magnitud y secuelas patológicas. El VZIK es un virus con envoltura lipídica, de genoma ARN de unos 10.000 pares de bases. Fue descubierto en Uganda, donde probablemente se originó, y fue introducido a varios países africanos, así como al Sur de Asia, generando dos linajes, uno africano y uno asiático. Este último linaje fue el introducido a las Américas, difundiéndose de forma expansiva en la región tropical. Aunque se pensaba inicialmente que la infección por este virus sería menos severa que la causada por el virus dengue, el gran número de casos ha permitido confirmar que la infección por VZIK de mujeres embarazadas conduce a graves secuelas como la microcefalia y que la infección en un porcentaje significativo de casos causa ezl Síndrome de Guillain Barre, una enfermedad autoinmune. No existe vacuna contra este virus, aunque el desarrollo de una vacuna contra el virus dengue podría agilizar el desarrollo de una vacuna contra el VZIK.
Palabras clave: Virus Zika, Virus emergentes, Arbovirus, Microcefalia, Américas.
Zika virus (ZIKV) is a flavivirus transmitted to humans by mosquitoes of the genus Aedes. This virus was introduced to South America in 2014, generating an epidemic of unexpected magnitude and pathological consequences. ZIKV is an enveloped virus, with a RNA genome of about 10,000 base pairs. It was discovered in Uganda, where it probably originated, and was introduced to several African countries and South Asia, generating two lineages, one African and one Asian. The latter lineage was introduced to the Americas, spreading expansively in the tropical region. Infection with this virus was initially thought to be less severe than that caused by dengue virus. However, the large number of cases has allowed confirming that the infection by VZIK of pregnant women leads to serious sequelae in the child, such as microcephaly and that infection in a significant percentage of cases causes the autoimmune disease Guillain Barre Syndrome. There is no vaccine against this virus, although the development of a vaccine against dengue virus could accelerate the development of a vaccine against VZIK.
Key words: Zika virus, Emerging viruses, Arbovirus, Microcephalia, Americas
Entre las emergencias virales del siglo XXI, varias han tenido una resonancia particular en el continente americano. Entre ellas, cabe mencionar la pandemia de influenza H1N1pd en 2009 y la triple epidemia actual de dengue, chikungunya y más recientemente Zika en la región. Esta revisión pretende cubrir la biología de este virus, así como intentar explicar las razones de esta emergencia, la inmunopatología comparada de estos virus y proponer algunas medidas de control de este grave flagelo.
La definición amplia de virus emergentes (Pujol, 2000) comprende a:
El virus Zika pertenece a la primera categoría por su emergencia explosiva en las Américas. Las razones de emergencias sucesivas de arbovirus en las Américas se deben a distintos factores:
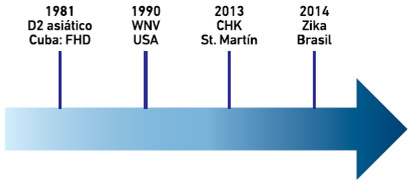
Interesantemente, las introducciones recientes de serotipos o genotipos nuevos de virus dengue (VD) o del virus chikungunya (VCHIK) en Suramérica se han producido desde el Caribe, mientras que la entrada del VZIK a las Américas fue directamente por tierra continental, en Brasil. Esta diferencia puede haber facilitado la rápida diseminación del virus en el continente.
El VZIK es un virus del género Flavivirus, perteneciente a la familia Flaviviridae. El VZIK fue aislado por primera vez en 1947 en el bosque de Zika, en Uganda (África oriental), a partir de la sangre de un mono Rhesus (Macaca mulatta) utilizado como centinela en actividades de vigilancia epidemiológica para el virus de la fiebre amarilla. El año siguiente el virus fue aislado en la misma localidad de mosquitos (Aedes africanus) (Dick et al. 1952). El VZIK fue detectado por primera vez en humanos, de un caso sintomático (fiebre y malestar general) en Nigeria en 1954 (Mac-Namara et al. 1954). Como los virus del dengue y chikungunya, el VZIK es transmitido por artropodos (arbovirus). Como otros arbovirus el VZIK probablemente se adaptó de un ciclo ancestral de transmisión que incluye primates no humanos y como vectores especies de mosquitos arborícolas selváticos, a un ciclo urbano-periurbano con humanos como reservorio y mosquitos Aedes (Stegomya) como vectores (Musso et al. 2015a),
La primera evidencia de circulación del agente en Asia se dio en 1966, aislándose el virus por primera vez a partir de mosquitos urbanos (Aedes aegypti), en Malasia (Marchette et al. 1969). En los años siguientes el virus estuvo asociado a brotes muy pequeños y esporádicos en Asia y en África hasta que en el 2007 hubo una epidemia importante en la Isla de Yap (Micronesia), donde cerca del 75% de la población resultó infectada, con síntomas de fiebre, rash, conjuntivitis y artralgia (Duffy et al. 2009). Evidencias basadas principalmente en datos de serología sugieren que el VZIK es endémico en toda África (excepto en el Norte del continente) y en varios países de Asia.
La siguiente epidemia se dio en la Polinesia Francesa en el Océano Pacifico, en los años 2013-2014, con alrededor de 30.000 casos sintomáticos (Cao-Lormeau et al. 2013). Antes de la epidemia en la Polinesia francesa la infección por el VZIK era normalmente descrita como una enfermedad febril no severa con síntomas que incluían dolores articulares y musculares, rash maculopapular, cefaleas y un aumento muy significativo de casos del síndrome de Guillain-Barré (SGB), una enfermedad neurológica severa, en su forma más grave causante hasta de parálisis. Otras enfermedades causadas por arbovirus como la fiebre del Nilo Occidental, encefalitis Japonesa, chikungunya, y dengue han sido reportadas también como causa de este síndrome (Leis et al. 2012; Ravi et al. 1994; Lebrun et al. 2009; Solomon et al. 2000). Aunque el aumento de número de casos observados fue importante, la circulación concomitante de dengue, que también había sido asociado con el síndrome, no había permitido establecer una relación causal entre la infección por el VZIK y el SGB.
Hasta el 3 de marzo del 2014, cuando Chile notificó la confirmación de un caso de transmisión autóctona de fiebre por VZIK en la Isla de Pascua, no existía evidencia de la presencia del virus en el hemisferio occidental. Este brote fue limitado ya que la enfermedad figura en los registros de la isla hasta junio de 2014.
A finales de 2014 y comienzo del 2015 se dio un brote de una enfermedad exantemática, con varios miles de casos en la región nororiental de Brasil. Finalmente, el 7 de mayo 2015 se confirmó oficialmente el primer caso autóctono de VZIK en un paciente de Bahía (ProMED, 2015). Para finales del 2015 se había confirmado la transmisión autóctona del virus en la mayoría de los estados, con un número estimado de casos entre 400.000 y 1.300.000 (Hennessey et al. 2016).
Se han planteado varias hipótesis sobre como el VZIK fue introducido en Brasil. Se consideró primero la idea que el virus había sido introducido durante el campeonato mundial de futbol, desarrollados en varias ciudades de esta nación entre junio y julio del 2014 (Hennessey et al. 2016). Debido a la ausencia de participantes de la Polinesia, de donde las evidencias filogenéticas sugieren el origen del VZIK circulante en Brasil, se planteó como una probable vía de introducción, el campeonato mundial de canoa desarrollado en Rio de Janeiro en agosto de 1914, con la participación de atletas originarios de varios países de Polinesia, región endémica para el VZIK (Musso et al. 2015).
Una vez establecido en Brasil, el VZIK se extendió a otras naciones del continente. En octubre del 2015 se confirmó la presencia del VZIK en Colombia en el Distrito Bolívar y luego en otros estados, con un estimado para mayo del 2016 de cerca de 75.000 casos reportados por el Instituto Nacional de Salud (http://www.ins.gov.co/boletin-epidemiológico/ BoletinEpidemiologico/2016Boletinepidemiologico semana19).
En Venezuela la presencia del VZIK se reportó por primera vez en noviembre del 2015 (European Centre for Disease Prevention and Control, 2015). El diagnóstico se realizó en el laboratorio nacional de referencia, Instituto Nacional de Higiene “Rafael Rangel”. Cuatro muestras resultaron positivas para el VZIK por la reacción en cadena de polimerasa en tiempo real. Los casos, cuyas edades estuvieron en el rango de 40 a 55 años, fueron mujeres del área limítrofe con Brasil (World Health Organization, 2015). Para finales de enero 2016 las autoridades de salud de este país reportaban la ocurrencia de aproximadamente 5.000 casos. Utilizando modelaje estadístico y datos oficiales, se estimaron para esa fecha 400.000 infectados con el VZIK en Venezuela (Castro, Julio S, comunicación personal). Paralelamente epidemiólogos de una organización no gubernamental, la “Red para la Defensa Nacional de Epidemiología” han propuesto un estimado parecido al propuesto por Castro. Si estos valores son correctos, Venezuela tendría una tasa de infecciones per cápita mayor que Brasil. Esto no es sorprendente, puesto que los índices aédicos (porcentaje de hogares con presencia de mosquitos) de Venezuela son los más altos de la región: aproximadamente 20%, comparados con 5% en Brasil (http://www.healthmap.org/site/diseasedaily/article/have-we-underestimated-zika-outbreakvenezuela-21916).
Para el 19 de mayo del 2016, 39 países del continente, incluyendo América del Norte, Centro, Sur y el Caribe, habían reportado casos autóctonos de VZIK (PAHO 2016). Esta expansión explosiva de casos se debe principalmente a dos factores: la distribución cuasi continental del mosquito Aedes aegypti, el principal vector del VZIK, así como también de los virus del dengue y del Chikungunya, y la falta de inmunidad de la población.
Esta emergencia explosiva del VZIK, con el consiguiente alto número de individuos infectados en los brotes recientes en los países del Pacifico Sur y de las Américas, permitió detectar la asociación de la infección con infrecuentes complicaciones neurológicas severas: el SGB en adultos en la Polinesia Francesa (Cao-Lormau et al. 2016) y la microcefalia congénita en neonatos en Brasil (Centro Europeo de Prevención y Control de Enfermedades, 2016; Schuler-Faccii et al. 2015). Efectivamente en Julio del 2015, ya Brasil había informado un incremento de casos de desórdenes neurológicos, incluyendo casos del SGB, en los estados más afectados por la transmisión del VZIK. Lo mismo se observó en otras naciones con brotes importantes del VZIK, incluyendo Colombia, República Dominicana, El Salvador, Honduras, Surinam y Venezuela. En general el SGB fue detectado alrededor de tres meses después de la confirmación de la circulación del VZIK en estas regiones.
Desde octubre de 2015 Brasil había reportado un aumento considerable de casos de microcefalia en neonatos y planteado su posible asociación con la infección de mujeres embarazadas con el VZIK (Soares de Araujo et al. 2016).Estas observaciones fueron luego confirmadas en otros países, incluyendo la Polinesia Francesa, donde estudios retrospectivos de las epidemias 2013-2014, en noviembre 2015, también confirmaron la ocurrencia de diferentes malformaciones del sistema nervioso en neonatos (Cauchemez et al.2016). Estudios retrospectivos de la epidemia en esta región también confirmaron convincentemente la asociación entre VZIK y los casos del SGB (Cao-Lormeau et al. 2016).
En consecuencia, de estos reportes, la Organización Mundial de la salud (OMS) el 1 de febrero 2016 declaró que la asociación entre el grupo de casos de microcefalia y otros desórdenes neurológicos, reportados en Brasil, que seguían una casuística similar a la observada en la Polinesia Francesa, constituían una emergencia de salud pública, de preocupación mundial, movilizando a nivel internacional las medidas correspondientes de prevención y control.
El VZIK es transmitido por mosquitos principalmente por el Aedes aegypti, el mismo que transmite el Dengue y Chikungunya (Hayes, E.B. 2009, CDC 2016). La infección por el VZIK es asintomática en aproximadamente el 80 % de los casos (CDC 2016, Duffy et al. 2009) y cuando el virus causa enfermedad, los síntomas generalmente son leves y espontáneos. Otras vías de transmisión para el VZIK han sido reportadas como son la sexual, materno-fetal y a través de transfusiones sanguíneas.
Al igual que otros virus del género Flavivirus, el VZIK es un virus ARN envuelto con cápside icosaédrica y su genoma está codificado en una sola cadena (monocatenario) no segmentada, de polaridad positiva, de aproximadamente 10,8 Kb, limitado por dos regiones no codificantes (5’NCR y 3’NCR). La poliproteína codificada es traducida y co- y posttraduccionalmente procesada por proteasas virales y celulares en tres proteínas estructurales, la cápside (C), la premembrana/membrana (PrM) y la envoltura (E), y siete proteínas no estructurales NS1, NS2A, NS2B, NS3, NS4A, NS4B Y NS5 (Faye et al. 2014; Lindenbach et al. 2009; Kuno et al. 2007).
El mosquito al picar deposita el virus en la epidermis y la dermis del huésped. Es poco lo que se conoce del mecanismo exacto de replicación del VZIK, sin embargo, se ha reportado que los fibroblastos de la piel y queratinocitos epidérmicos, así como las células dendríticas inmaduras son altamente permisivas a la infección con VZIK (Hamel et al. 2015). La infección de los fibroblastos de la piel rápidamente resulta en la presencia de un alto número de copias de ARN y un incremento gradual con el tiempo de la producción de partículas virales, lo que indica la replicación activa en las células infectadas.
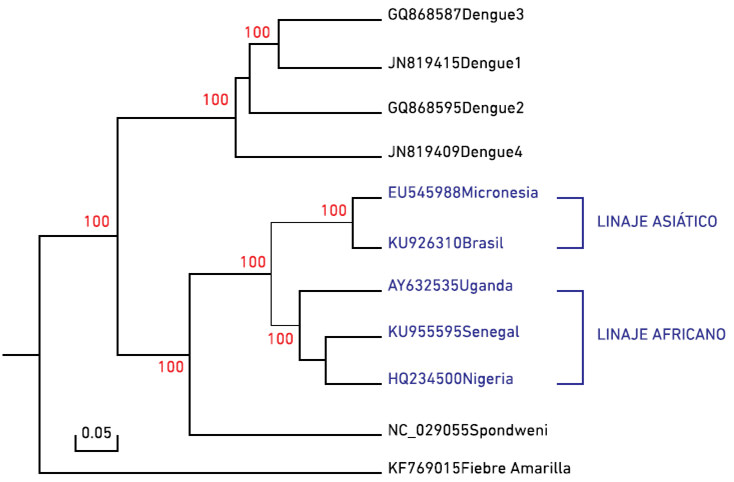
Se han descrito dos linajes del VZIK, el linaje africano y el linaje asiático. Algunos estudios filogenéticos indican que el virus que está expandiéndose por el continente americano está estrechamente relacionado con cepas provenientes del linaje asiático (Enfissi et al. 2016) (Figura 2), aunque el linaje africano oriental es el originario (Cao-Lormeau et al. 2014). El análisis de las secuencias disponibles del virus Zika por estudios filogenéticos de coalescencia sugieren un origen del virus hacia 1920 en Uganda (Faye et al. 2014).
La infección por el VZIK provoca un amplio rango de síntomas que son comunes con otras enfermedades transmitidas por Aedes tales como Dengue y Chikungunya, que hacen difícil el diagnóstico diferencial. El diagnóstico de la infección por el VZIK se basa en técnicas de aislamiento viral, detección de ARN y determinación de anticuerpos.
Durante la fase aguda de la enfermedad clínica (fase febril, virémica), se puede detectar el genoma viral en el suero de los paciente por técnicas de biología molecular tales como RT-PCR estándar o en tiempo real. Desde el día 5 de iniciados los síntomas, se puede detectar la respuesta serológica inducida por el virus (IgM y/o IgG). El ARN del VZIK también se ha detectado en la orina, semen y saliva de pacientes (Gourinat et al. 2015, Musso et al. 2015b, Musso et al. 2015c). En orina la deteccion del ARN se ha reportado hasta tres semanas después de iniciados los síntomas, en semen el virus puede permanecer por más tiempo que en la sangre, mientras que en la saliva la detección del genoma viral pareciera ser la misma que la observada en sangre. Estas observaciones sugieren que el diagnóstico molecular del VZIK, como ocurre para VD puede realizarse en orina después que ha desaparecido el virus en sangre, ampliando así la ventana para la detección del ARN del VZIK. Recientemente por RT-PCR también se ha identificado el ARN viral en fluído amniótico (Calvet et al. 2016; PAHO 2015), aunque la sensibilidad y especificidad del test para detectar la infección congénita es incierta.
No existen pruebas de diagnóstico serológico comercialmente disponibles o aprobadas por la Administración de Alimentos y Medicamentos (FDA) de los Estados Unidos para la detección de infección por el VZIK. Sin embargo, la FDA ha autorizado a laboratorios certificados durante la emergencia, el uso de dos herramientas de diagnóstico para el VZIK, el Zika MAC-ELISA para la detección cualitativa de anticuerpos IgM específicos en suero y fluido cerebroespinal. También ha autorizado el ensayo Trioplex Real-Time RT-PCR (Trioplex rRT-PCR), el cual es una prueba de laboratorio diseñada para detectar la infección por el VZIK, VD y VCHIK en humanos. Estas pruebas están siendo distribuidas a laboratorios certificadas para realizar pruebas en los Estados Unidos (http://www.cdc.gov/zika/hc-providers/ index.html).
La interpretación de los test serológicos es especialmente importante en el diagnóstico de VZIK. En una infección primaria con flavivirus existe poca reactividad cruzada con anticuerpos de otros virus genéticamente relacionados. Sin embargo, se ha demostrado que sueros de individuos con historia previa de infección con otro flavivirus (especialmente Dengue, fiebre Amarilla y Nilo del Oeste) pueden presentar reacción cruzada en las pruebas serológicas. En los ensayos de neutralización por reducción de placas (PRNT), los cuales ofrecen una mayor especificidad en la detección de anticuerpos neutralizantes (IgG), también se ha documentado la reacción cruzada.
En cuanto a los resultados para RT-PCR VZIK, un resultado negativo no descarta el diagnóstico de fiebre por VZIK debido a que el periodo de viremia es corto y variable. El periodo de incubación se ha descrito desde 3,5 días en humanos voluntarios (Bearcroft, 1956) hasta 6-10 días en viajeros retornando y donantes de sangre (Kutsuna et al. 2014; Musso et al. 2014).
La patología del VZIK, así como de los VD y VCHIK, presenta un componente de inmunopatología muy marcado (Tabla 1).
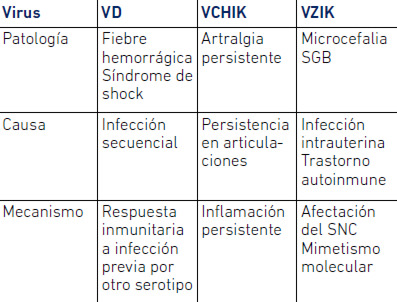
La inmunopatología que conduce a la manifestación hemorrágica de algunas infecciones secundarias por VD ha sido estudiada en extenso. Se sabe que el riesgo de la manifestación hemorrágica está relacionado con la infección por un segundo serotipo del VD. En esa manifestación participan anticuerpos facilitadores, anticuerpos producidos contra el serotipo de la infección previa de virus dengue, que en lugar de impedir la infección del nuevo serotipo infectante, le permiten acceder a la célula y a otros tipos celulares. A través de la interacción del virus con estos anticuerpos no neutralizantes, el virus logra ser internalizado en las células a través del reconocimiento de la porción Fc de los anticuerpos, logrando así una mayor y más variada infección de células. El proceso de estimulación de citoquinas que desencadena esta infección, que varía entre individuos de acuerdo a su inmunogenética, es lo que terminará determinando la severidad del ataque al endotelio y por ende la manifestación hemorrágica (Rothman, 2011).
Aunque la infección por el VCHIK es considerada menos severa que la infección por VD, pueden existir casos severos de la enfermedad generalmente asociados a co-morbilidades (Caglioti et al. 2013). La infección está asociada igualmente en un porcentaje significativo de los casos a secuelas de artralgia, debido a la persistencia del virus en las articulaciones y la subsecuente inflamación debido a la respuesta inmunitaria al virus (Petitdemange et al. 2015).
Recientes evidencias sugieren una asociación entre la infección materna por el VZIK y manifestaciones fetales adversas, como la microcefalia congénita (ECDC, 2015; Oliveira et al. 2016). Tang et al. (2016) han demostrado en pruebas experimentales, que el VZIK infecta eficazmente células progenitoras neurales humanas (hNPCs) derivadas de células madre pluripotentes inducidas. La asociación entre zika y microcefalia ha sido demostrada también en modelos animales (Malkhi, 2016).
También se asocia la infección por VZIK con el Síndrome de Guillain-Barré (SGB). El SGB consiste en una neuropatía periférica de tipo autoinmune, debida frecuentemente a la producción de anticuerpos anti-gangliósidos (Anaya et al. 2016). La abundante presencia de estos gangliósidos en la mielina conduce al daño en la mielina de nervios periféricos y por ende a la parálisis (Yuki et al. 2012).
Las manifestaciones patológicas de la infección por VZIK, superaron las expectativas que se tenían para una infección que se pensaba en buena proporción asintomática. Se ha planteado la posibilidad de que esto se deba a un fenómeno de facilitación de anticuerpos por la epidemia del VD existente en la región latinoamericana. Recientes evidencias sugieren que anticuerpos dirigidos contra el VD podrían facilitar la infección in vitro del VZIK (Paul et al. 2016). Sin embargo, esta información debe ser tomada con cautela, hasta que se demuestre este fenómeno en un modelo in vivo.
Por otra parte, estudios moleculares confirman lo discutido previamente sobre la relativa rápida evolución del VZIK. En particular, ciertos cambios en aminoácidos de la proteína preM podrían estar asociados a un incremento en neurovirulencia y mayor capacidad adaptativa (Wang et al. 2016).
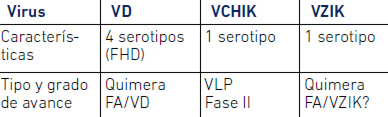
No existe hasta el presente una vacuna para VZIK, aunque algunas en desarrollo están basadas en las tecnologías utilizadas en las vacunas contra el dengue, que se basa en una quimera entre VD y Fiebre Amarilla (FA) (Tabla 2). Por otra parte, el uso de un anticuerpo monoclonal que reconoce todos los flavivirus (Dai et al. 2016) podría permitir desarrollar una eventual inmunoterapia contra el VZIK.
Por tanto las medidas de prevención son las mismas que se recomiendan para todas las enfermedades transmitidas por las picadas del mosquito Aedes que no tienen vacunas, que incluyen la protección individual a las picaduras de moquitos y el control del vector. Otro punto importante a considerar en el control de estas arbovirosis es la posibilidad de un reservorio selvático, es decir que primates no humanos puedan ser reservorios de la enfermedad. Se ha sugerido recientemente la infección de primates no humanos en Brasil (Favoretto et al. 2016), aunque se requieren más estudios para confirmar el real significado de estos hallazgos preliminares en la posibilidad de que se desarrolle un reservorio selvático en América.
La propagación del VZIK ha llevado a la necesidad de desarrollar nuevas estrategias de control de vectores dentro de las que destacan:
Un nuevo virus emergente azota la región latinoamericana, conduciendo a una situación bastante única, como lo es una triple epidemia de arbovirus (VD, VCHIK y VZIK). La epidemia por VZIK, inicialmente pensada en producir bajas secuelas desde un punto de vista de morbilidad, ha resultado un serio problema de Salud Pública, que ha encendido las alarmas para investigar más a fondo los mecanismos inmunopatológicos involucrados en esta infección, así como ha acelerado la necesidad de producir una vacuna contra este agente viral. El panorama nos sugiere que debemos prepararnos mejor para futuras epidemias, ya que existe una alta probabilidad que sigan emergiendo otras arbovirosis, como recientemente ha ocurrido de forma repetida en la región.
Tampoco podemos olvidar que existen otras epidemias muy activas en nuestro país, como la Malaria, que ha incrementado su extensión geográfica de afectación en el país, la fiebre hemorrágica venezolana que periódicamente resurge en el Estado Portuguesa y una epidemia de VIH que afecta a nuestra población Warao.