El estudio de los factores que regulan la neurogénesis durante el desarrollo del sistema nervioso y en el adulto es indispensable para el desarrollo exitoso de estrategias terapéuticas. Entre estos factores se encuentran el GABA y el neuroesteroide, 3α,5α-tetrahidroprogesterona (3α,5α-THP o alopregnanolona), un potente modulador positivo del receptor GABAA. Demostramos que progenitores neurales PSA-NCAM+ aislados de cerebro de rata recién nacida eran capaces de sintetizar in vitro tanto GABA como 3α,5α-THP, los cuales estimulaban de manera autocrinao paracrina la proliferación de estas células vía receptor GABAA. Por otra parte, establecimos la distribución de la enzima responsable de la síntesis de la 3α,5α-THP, en el cerebro de rata durante el desarrollo embrionario y postnatal y en el cerebro adulto. La expresión de la enzima es significativa en las zonas neurogénicas, desde las etapas embrionarias hasta las postnatales, y aunque disminuye durante el desarrollo, persiste en los nichos neurogénicos del adulto. Los resultados sugieren que la 3α,5α-THP pudiese participar en el control de la neurogénesis in vivo. Finalmente, estudiamos in vivo, el efecto de la 3α,5α-THP sobre la proliferación de los progenitores neurales (PN) de un nicho neurogénico del adulto; la zona subventricular y la corriente migratoria rostral. Los resultados revelaron un efecto dual de la 3α,5α-THPsobre la proliferación de estos PN; inhibitorio a bajas concentraciones y estimulatorio, a altas concentraciones vía receptores GABAA. El conjunto de estos resultados apoya el posible rol de la 3α,5α-THP en el control de la neurogénesis durante el desarrollo y en el cerebro adulto.
Palabras clave: neurogénesis; progenitor neural; 3α,5α-tetrahidroprogesterona; alopregnenolona; GABA.
The study of factors that regulate neurogenesis during nervous system development and in the adulthood is essential for the successful development of therapeutic strategies. Among these factors are GABA and the neurosteroid3α,5α-tetrahydroprogesterone (3α,5α-THP o allopregnanolone), a potent positive modulator of GABAA receptor. We demonstrated that neural progenitors PSA-NCAM+ isolated from newborn rat brain were able to synthetize in vitro, GABA and 3α,5α-THP, which both stimulated, in a autocrine or paracrine manner, the proliferation of these cells acting through GABAA receptor. Furthermore, we established the distribution of the enzyme responsible for the synthesis of 3α,5α-THP in the rat brain during embryonic and postnatal development and in the adult brain. The enzymeexpressionis ignificant in neurogenic zones, from embryonic to postnatal stages and even if it decreases during development, it persists in adult neurogenic niches. These results suggest that 3α,5α-THP could participate in the control of neurogenesis in vivo. Finally, we studiedin vivo, the effect of 3α,5α-THP on the proliferation of neural progenitors (NP) belonging to an adult neurogenic niche; the subventricular zone and rostral migratory stream.The results revealed a dual effect of 3α,5α-THP on NP proliferation; inhibitory at low concentrations and stimulatory, at high concentrations, through GABAA receptors. All these results support the possible role of 3α,5α-THP in the control of neurogenesis during development and in the adult brain.
Key words: neurogenesis; neural progenitor; 3α,5α-tetrahydroprogesterone; llopregnanolone; GABA.
Por mucho tiempo se pensó, que una vez culminado el desarrollo del sistema nervioso, las células madre neurales (CMN) y los progenitores neurales (PN) desaparecían por completo. Sin embargo, actualmente se sabe que estas células persisten en nichos neurogénicos en el tejido adulto, sirviendo como fuente de nuevas células nerviosas durante toda la vida, y pudiendo incluso participar en procesos regenerativos. Los nichos neurogénicos mas estudiados son la zona subventricular(ZSV)delos ventrículoslateralesyenlazonasubgranular delgirodentadodelhipocampo. Con respecto a la ZSV, ésta es considerada eláreaconla mayor reserva de CMN y de PN, así como una de las zonas neurogénicas de mayor actividad en el cerebro adulto (revisado por Galli y col., 2003; revisado por Bordey, 2006). A partir de la ZSV se generan neuroblastos que migran siguiendo la corriente migratoria rostral (CMR), hasta llegara los bulbos olfatorios en donde se diferencian en interneuronas (Doetsch y Alvarez-Buylla, 1996). El estudio en profundidad de la biología de las CMN y de los PN, y en particular de los factores que regulan la proliferación, migración, diferenciación y supervivencia de estas células, es indispensable para el desarrollo exitoso de estrategias terapéuticas.
En la regulación de la neurogénesis intervienen diversos factores que actúan durante el desarrollo y que persisten en los nichos neurogénicos en la etapa adulta. Además de los factores de crecimiento y factores morfogénicos, otras moléculas están cobrando interés, este es el caso de neurotransmisores, en particular del ácido γ-aminobutírico (GABA) y de los neuroesteroides, como la 3α,5α-tetrahidroprogesterona (3α,5α-THP o alopregnanolona) un metabolito neuroactivo de la progesterona que actúa como un potente modulador del receptor GABAA.
El GABA es el principal neurotransmisor inhibitorio del sistema nervioso central (SNC) adulto actuando vía receptores ionotrópicos (receptores GABAA y GABAC) y vía receptores metabotrópicos (receptores GABAB). El receptor GABAA es el que está más ampliamente distribuido en el SNC.Está formado por 5 subunidades pero éstas presentan una gran diversidad, lo cual permite la conformación de diversos receptores GABAA con propiedades farmacológicas diferentes. La interacción del GABA con sus receptores GABAA produce la apertura de un canal de Cl-, generando la entrada de este ion a la célula y por lo tanto un potencial postsináptico inhibitorio (revisado por Ben-Ari y col., 2007). Durante el desarrollo, el GABA ejerce efectos excitatorios y no participa en la neurotransmisión, sino que ejerce efectos morfogénicos, por vía de modular la proliferación, migración y diferenciación de los PN (revisado por Bordey, 2006). Durante el desarrollo, la unión del GABA a los receptores GABAA produce la despolarización de los PN. Esto se debe a que en estas células inmaduras, la concentración intracelular de Cl- es más elevada que en el adulto, por lo que, cuando el GABA se une a sus receptores GABAA se produce una salida de Cl- y la consecuente despolarización de la célula (revisado por Ben-Ari y col., 2007; Ganguly y col., 2001). Posteriormente, se produce la apertura de canales de Ca2+ dependientes de voltaje y la entrada de Ca2+ al interior celular (revisado por Ben-Ari y col., 2007), lo que activa una serie de respuestas intracelulares que explican los efectos morfogénicos del GABA durante el desarrollo.
Por ejemplo, en PN neonatales que expresan la forma polisialilada de la molécula de adhesión celular neural (PSA-NCAM), describimos la expresión de distintas subunidades del receptor GABAA en progenitores PSA-NCAM+ purificados, y demostramos que el GABA incrementaba la proliferación de estas células de manera dosis-dependiente y de forma específica vía receptores GABAA (Gago y col., 2004).
Enlos nichos neurogénicos del cerebro postnatal se han reportado efectos similares a los observados durante el desarrollo. En efecto, se ha descrito que los PN dela ZSV y de la CMR, producen GABA, expresan receptores GABAA, y pueden ser despolarizados por efecto del GABA (Wang y col., 2003). Por otra parte, se ha visto que estas señales gabaérgicas disminuyen la velocidad de migración de los neuroblastos en la ZSV y la CMR, y que disminuyen la proliferación de neuroblastos y astrocitos localmente (revisado por Bordey, 2006). Actualmente, se considera que el GABA actúa como un factor morfogénico importante durante el desarrollo del SNC y que esta señal está conservada en el adulto en los nichos neurogénicos, en donde, mediante mecanismos autocrinos y/o paracrinos, modula una serie de aspectos de la biología de las CMN y de los PN tales como la proliferación, la migración y la diferenciación celular.
El efecto excitatorio del GABA está ampliamente mediado por los receptores GABAA los cuales son el blanco de un cierto número de drogas psicoactivas, como las benzodiacepinas, los barbitúricos, el alcohol, así como de los neuroesteroides (revisado por Sieghart, 1995; Lambert y col., 2003).
Los neuroesteroides son esteroides sintetizados de novo en el sistema nervioso a partir del colesterol o a partir de esteroides circulantes, capaces de ejercer efectos autocrinos y/o paracrinos (Schumacher y col., 2000). La biosíntesis de los neuroesteroides se inicia con la formación de pregnenolona a partir de colesterol por acción del citocromo P450scc. Luego, la pregnenolona es convertida a progesterona (PROG) por la enzima 3β-hidroxiesteroide deshidrogenasa/Δ5-Δ4isomerasa(3β-HSD). La PROG es luego reducida por la 5α-reductasa, en 5α-dihidroprogesterona (5α-DHP). A partir de ésta se forma la 3α,5α-tetrahidroprogesterona (3α,5α-THP) ó alopregnanolona y el isómero 3β(3β,5α-THP), gracias a la acción de la 3α-hidroxiesteroideoxidoreductasa(3α-HSOR) y de la 3β-h idroxiesteroideoxidoreductasa(3β-HSOR), respectivamente (Gagoycol., 2001; Schumacher y col., 2000) (Fig. 1).
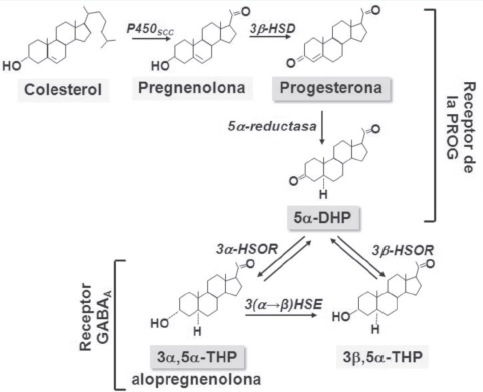
Los neuroesteroides ejercen sus efectos a través de mecanismos de acción genómicos y no genómicos (Schumacher y col., 2000; revisado por Compagnone y Mellon, 2000). En los mecanismos genómicos, los neuroesteroides actúan regulando la transcripción de genes sensibles a hormonas. En los mecanismos nogenómicos,los neuroesteroides pueden actuar a través de receptores específicos de membrana o actuar a través de receptores para neurotransmisores en la membrana plasmática. Este es el caso dela 3α,5α-THP, la cual actúa como un modulador alostérico positivo de los receptores GABAA(revisado por Brinton y col., 2008). Debido a esto, la 3α,5α-THP es capaz de disminuir la excitabilidad neuronal y degenerar una serie de efectos fisiológicos y farmacológicos, tales como efectos anticonvulsivantes, analgésicos, anestésicos, ansiolíticos y efectos sobre el estrés, el sueño, la depresión y la memoria (Schumacher y col., 2000).
Por otro lado, también se le han atribuido a los neuroesteroides efectos tróficos y regenerativos sobre el sistema nervioso (Schumacher y col., 2000). Dentro de los efectos neurotróficos destacan los que ejercen la PROG y sus metabolitos 5α-reducidos sobre la síntesis de mielina en el sistema nervioso. Por ejemplo, en el sistema nervioso periférico, se ha demostrado que la PROG, la 5α-DHP y la 3α,5α-THP, estimulan la producción de mielina por partede las células de Schwann, mediante la activación de los genes que codifican para varias de las proteínas de la mielina (Koening y col., 1995; Melcangi y col., 1999).
En el SNC, pudimos demostrar que PN PSA-NCAM+ aislados de cerebro de rata recién nacida eran capaces de sintetizar in vitro varios esteroides biológicamente activos,como la PROG y la 3α,5α-THP(Gago y col. 2001). Adicionalmente, observamos que la actividad de la enzima 3α-HSOR encargadadela síntesis de la 3α,5α-THP, era particularmente elevada en estos progenitores con respecto a la registrada en otras células nerviosas como los progenitores de oligodendrocitos, los oligodendrocitos diferenciados (Gago y col. 2001) y las neuronas (Gago, 1998). Posteriormente, demostramos que los progenitores PSA-NCAM+ también eran capaces de sintetizar GABA, y observamos que tanto el GABA como 3α,5α-THP, estimulaban de manera autocrina y/o paracrina la proliferación de estos PNactuando vía receptores GABAA. (Gago y col., 2004) (Fig. 2). Estos resultados fueron posteriormente confirmados por Wang y colaboradores en 2005.
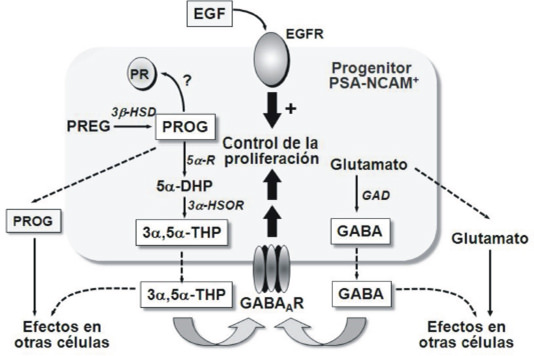
Debido a que la mayoría de los resultados que apoyan un papel de la neuroesteroides y en particular de la 3α,5α-THP como posible modulador de la neurogénesis han sido obtenido in vitro a partir de cultivos celulares hemos desarrollado más recientemente proyectos cuyo objetivo central es el de establecer el efecto de la 3α,5α-THP sobre la biología de las CMN y de los PN en condiciones in vivo.
Como primera aproximación, decidimos establecer, la distribución de la enzima 3α-HSOR responsable de la síntesis de la 3α,5α-THP en el cerebro de rata durante el desarrollo embrionario ypostnatal. Esto fue realizado por inmunofluorescencia utilizando primero un anticuerpo policlonal anti-3α-HSOR no comercial desarrollado en conejo contra la enzima purificada de hígado de rata (Penning y col., 1984) y luego un anticuerpo policlonal desarrollado contra un péptidosintético dela enzima. Este anticuerpofuerealizado en colaboración conlosdoctores Yelitza Campos yWalter Mosca del laboratorio de Fisiopatología del Instituto de Biomedicina, Escuela de Medicina J. M.Vargas.
Observamos que, en general la 3α-HSOR se expresa ampliamente durante el desarrollo siguiendo un patrón espacio-temporaldefinido (Alcalá, 2009).Laexpresióndela3α- HSOResconsiderableenlaszonas neurogénicas, desde las etapas embrionarias hasta las etapas postnatales, siendo más alta al comienzo del desarrollo embrionario y durante el período comprendido entrelos días postnatales 7 y 12(P7 y P12). Durante el desarrollo, la 3α-HSOR también se expresa en zonas no neurogénicas clásicas, como en la corteza y en el cerebelo. Adicionalmente, cabe destacar dos resultados particularmente interesantes queobtuvimos a partir de estos trabajos, primero, la alta expresión de la 3α-HSOR en las células endoteliales siguiendo también unpatrónespacio-temporaldefinidoysegundo,laaltaexpresióndelaenzimae nlo que denominamos la extensión caudal de la zona subventricular (ECZSV) (Alcalá, 2009; Pernía, 2012).
La ECZSV es unnicho neurogénicoaúnpocoestudiado el cual reviste los ventrículos laterales,se sitúa entre el hipocampo y el cuerpo calloso, y en su parte anterior, forma un continuo con la ZSV, debido a esto lo hemos denominado extensión caudal de la ZSV. Ent érminosgenerales,losresultados btenidosmuestranqueestenichopresentagrandescambiosestructuralesduranteeldesarrollo postnatal y que constituye una fuente importante de células gliales (Pernia, 2012). En efecto,observamos durante el desarrollo postnatal, una muy alta densidad de células 3α-HSOR+ que forman cadenas radiales que penetran en el cuerpo calloso. La expresión de la 3α-HSOR en la ECZSV incrementa en los primeros días postnatales, alcanza un máximo en P12, y posteriormentedisminuye.Las cadenas radiales desaparecen en P21, quedandosólocélulas3α-HSOR+ aisladas,dispersasenlasustanciablanca. Laexpresión dela3α-HSORenlaECZSVyenlascadenasradialesquesederivandeésta,sugierequela3α, 5α-THPpudiesemodular, in vivo,ciertosaspectosasociadosalafuncióndeestenichoneurogén ico,comola producción de células gliales (oligodendrocitos y astrocitos)duranteeldesarrollo postnatal, la migración de las mismas al cuerpo calloso y la corteza y el proceso de mielinización(Pernia, 2012).
De igual forma establecimos la distribución de la 3α-HSOR en el cerebro de rata adulta (Gagoycol., 2007).Los resultados obtenidos muestran que la 3α-HSOR se expresa ampliamente en todo el cerebro, lo cual concuerda con el efecto modulatorio de la 3α,5α-THP sobre losreceptoresGABAA descrito en los individuos adultos.Porotraparte,tambiénobservamosquela3α-HSORseexpresaenzonas neurogénicas como la ZSV, la CMR y la zona subgranular del giro dentado del hipocampo (Fig. 3).
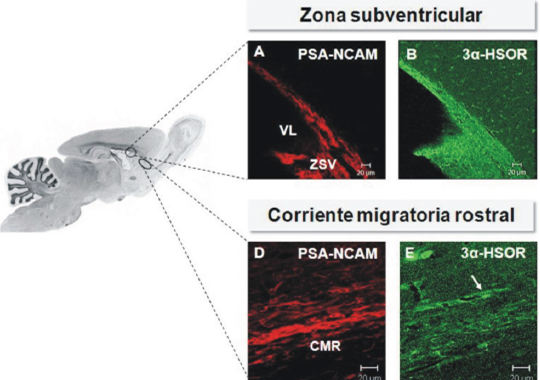
De igual forma, también observamos laexpresión dela 3α-HSOR en estructuras dotadas de una alta plasticidad como lo son los bulbos olfatorios,los bulbos olfatorios accesorios, el hipocampo yla fimbria del hipocampo,lo que sugiere que la 3α,5α-THPpudiesecontribuira laremodelacióndecircuitosneuronales. Enconjuntoestosresultados aportan evidencias anatómicas de que la 3α,5α-THP pudiese participar en el control de la biología de losPNqueresidenenlosnichosneurogénicos del cerebro adulto.
Como segunda aproximación para establecer el posible efecto de la 3α,5α-THP sobre la biología de las CMN y de los PN en condicionesin vivo, desarrollamos otro proyecto cuyo objetivo fue el de establecer el efecto de la 3α,5α-THP sobre la proliferación de los PN de la ZSV y de la CMR en el cerebro de rata adulta, en condiciones in vivo. Para ello, trabajamos con ratas macho adultas y la proliferación celular fue evaluadamediante inmunohistoquímica cuantificando la expresión delantígeno nuclear celular de proliferación (PCNA). Lo primero queinvestigamosfue el efecto de la 3α,5α-THP endógena mediante la inhibición de su biosíntesis administrando finasterida, un inhibidor de la 5α-reductasa. Los resultados revelaron que los metabolitos 5α-reducidos, dentro de los cuales se encuentra la 3α,5α-THP, inhiben la proliferación de los PN tanto en la ZSV como en la CMR (Gazzen, 2015). Posteriormente, se evaluó el efecto de la administración exógena de 3α,5α-THPpor vía intracerebroventricular a nivel de los ventrículos laterales, encontrándose que el neuroesteroide ejerce un efecto estimulatorio sobrela proliferación de los PN, el cual pudo ser abolido mediante la administración de picrotoxina (un antagonista del receptor GABAA)(Gazzen, 2015). Estos resultados muestran un efecto dual de la 3α,5α-THPsobre la proliferación de los PN de la ZSV y de la CMR; inhibitorio a bajas concentraciones y estimulatorioa altas concentraciones, vía receptores GABAA. Los efectos duales o bi-fásicos de los neuroesteroides han sido ampliamente descritos en la literatura (revisado por Whang, 2011).
El conjunto de todos estos resultados apoya la hipótesis sobre el posible rol de la 3α,5α-THP en el control de la neurogénesis.En efecto, el estudio de la distribución de la 3α-HSOR en el cerebro de rata durante las etapas embrionarias y postnatales, proporcionó evidencias anatómicas significativas en cuanto a la posible función de la 3α,5α-THP como modulador de los procesos de neurogénesis y de mielinización. La persistencia de la expresión de esta enzima en los nichos neurogénicos del adulto sugiere que esta señal se conserva en estas zonas como un factor morfogénico, lo cual pudimos en efecto demostrar en la ZSV y en la CMR, en donde la 3α,5α-THP actúa como un factor regulador de la proliferación celular de los PN. Estos resultados aumentan nuestro conocimiento sobre la neurogénesis y los factores capaces de modularla y potencialmente pudiesen contribuir al desarrollo de estrategias terapéuticas dirigidas a mejorar la regeneración del SNC.
3α,5α-THP: 3α,5α-tetrahidroprogesterona o alopregnanolona. 3α-HSOR: 3α-hidroxie steroideoxidoreductasa. 3β-HSD:3β-hidroxiesteroide deshidrogenasa/Δ5-Δ4 isomerasa. 3β-HSOR: 3β-hidroxiesteroideoxidoreductasa. 3(α→β)HSE: 3(α→β) hidroxiesteroideepimerasa. 5α-DHP: 5α-dihidroprogesterona. 5α-R: 5α-reductasa. CMN: célula madre neural. CMR: corriente migratoria rostral. ECZSV: extensión caudal de la zona subventricular. EGF: factor de crecimiento epidérmico. EGFR: receptor del factor de crecimiento epidérmico. GABA: ácido γ-aminobutírico. GABAAR: receptor GABAA. GAD: glutamato descarboxilasa. P450scc: citocromo P450scc.PCNA: antígeno nuclear celular de proliferación. PN: progenitor neural. PR: receptor de la progesterona. PREG: pregnenolona. PROG: progesterona. PSA-NCAM: forma polisialilada de la molécula de adhesión celular neural. SNC: sistema nervioso central. ZSV: zona subventricular de los ventrículos laterales.
Este trabajo ha sido financiado en parte por el Consejo de Desarrollo Científico y Humanístico de la Universidad Central de Venezuela (PI 09-11-5236-2007; PG 09-00-6794-2007) y el Programa Ecos-Nord (N° 20238).