La Enfermedad de Chagas (ECh), es causada por el agente etiológico Trypanosoma cruzi (T. cruzi) y es el principal causante de cardiomiopatías crónicas en América Latina. Probablemente el daño cardiaco es la consecuencia no solamente de la persistencia del parásito en el tejido cardiaco sino también de una regulación defectuosa de la respuesta inmunitaria (teoría autoinmune)derivada de la auto-reactividad contra antígenos propios. Se ha demostrado la presencia de anticuerpos dirigidos contra la segunda asa extracelular del receptor β1 adrenérgico en suero de pacientes conECh. La estandarización de la prueba es necesaria para garantizar la obtención de resultados confiables y comparativos en la determinación de la presencia de anticuerpos anti-β1 adrenérgicos en pacientes en fases tempranas de la infección y vigilar de cerca su evolución clínica. Se ensayaron diferentes concentraciones del antígeno (30μg/ml, 50μg/ml y 70 μg/ml), diluciones de los sueros (1/20, 1/50, 1/60) y del conjugado (anti-IgG humano, acoplado a fosfatasa alcalina) en placas de 96 pozos con sueros de personas con ECh con alta, media y baja reactividad en el ELISA de diagnóstico así como de personas negativas a fin de fijar el punto de corte de la prueba. Las condiciones evaluadas para la estandarización de la prueba resultaron apropiadas para la detección de los anticuerpos anti-β1 adrenérgicos en pacientes con Enfermedad de Chagas.
Palabras clave: Enfermedad de Chagas; ELISA; receptores β1 adrenérgico; Estandarización; péptidos sintéticos.
Chagas disease is caused by the etiologic agent tripanosomacruzi (T. cruzi)and is the main cause of chronic cardiomyopathy in Latin America. Probably the heart damage is a resultnot only the persistence of the parasite in the cardiac tissuebut also of a defective regulation of the immune response (autoimmune theory). It has demonstrated the presence of antibodies directed against the second extracellular loop β1 adrenergic receptor in serum of patients with Ech. The standarization of testing is necessary to ensure obtaining reliable results and comparative, the objective study was performed to standarize the test (ELISA) for the detection of anti-β1 adrenergic antibodies in patients with Ech,were determined optimal concentrations of antigen (30μg/ml, 50μg/ml y 70 μg/ml),optimal dilution of sera(1/20, 1/50, 1/60) and the optimal conjugate title (anti - human IgG, coupled to alkaline phosphatase) in 96-well plates with serums of high, medium and low reactivity. To discriminate positive sera from negative the cutoff was determined. It was selected as the optimal concentration of antigen50μg/mldilutions of serum 1/50 and conjugate1/500the cut that was set at D.O 0,278 nm. The conditions evaluated for standardized testing, were appropriate for the detection of anti-β1 adrenergic antibodies in patients with Chagas disease.
Key words: Chagas disease; ELISA; β1 adrenergicreceptor;Standarization;synthetic peptide.
La Enfermedad de Chagas (ECh) ó tripanosomiasis americana es causada por el agente etiológico Trypanosoma cruzi (T. cruzi) y es el principal causante de cardiomiopatías crónicas en América Latina, encontrándose alrededor de 8 millones de personas infectadas (World Health Organization, 2014). Esta enfermedad se caracteriza por presentar una fase aguda y crónica, separadas por un periodo indeterminado que puede durar meses o décadas durante el cual los pacientes son relativamente asintomáticos (Oliveira et al 1997; Storino 1994; Viotti y Vigliano 2015).
Existen controversias y aún no están claramente establecidos los mecanismos causantes de la patología cardiaca y las causas reales por las cuales un individuo puede evolucionar o no hacia una cardiopatía. Sin embargo, a través del análisis comparativo de distintos pacientes con ECh se ha logrado inferirla existencia de diversos factores que condicionan en un porcentaje de la población infectada el desarrollo de la fase crónica cardiópata, entre ellas: la predisposición genética del hospedador, lesiones producidas por el parásito y respuesta del sistema inmunitario (Dutra et al, 2009).
Se estima que el daño cardiaco se debe no solo a la persistencia del parásito en el tejido cardiaco sino también a una regulación defectuosa de la respuesta inmunitaria de una autoreactividad innata y adaptativa contra antígenos propios del organismo (Brener et al, 2000). Varios estudios han demostrado la presencia de anticuerpos dirigidos contra la segunda asa extracelular del receptor β1 adrenérgico en suero de pacientes con enfermedad de Chagas (Sterin-Borda et al, 1976; Magnusson et al, 1991; Mijares et al, 1996; Chiale et al 1994; Wallukat et al, 1995), relacionándolos con el desarrollo de la patología cardiaca. La interpretación cambiante de la patogenia de la miocardiopatia crónica de la ECh está relacionada con la evolución de la tecnología y la era de la biología molecular a partir de los años 90 (Laguens et al 2015) y es por eso que no se descarta la participación de los dos componentes parásito y huésped.
La detección de los anticuerpos β1 adrenérgicos podría tener valor clínico como marcadores de morbilidad; pero para esto se debe realizar una debida estandarización y valides de la prueba a usar en cada grupo de laboratorio donde se desee realizar esta prueba.
Hasta el momento la prueba por excelencia para la detección de estos anticuerpos ha sidola técnica ELISA, la cual generalmente tiene alta sensibilidad, especificidad y reproducibilidad (Ochoa, 2012). La estandarización y validez de la prueba se hace necesaria para garantizar la obtención de resultados confiables para la toma de decisión sobre el avance de una patología cardiaca en un grupo de pacientes, por lo tanto el objetivo del presente estudio fue realizar la estandarización de la prueba de inmunoensayo enzimático ELISA con el péptido sintético de la segunda asa extracelular del receptor β1 adrenérgico humano para la detección de los anticuerpos anti-β1 adrenérgicos en pacientes con ECh.
Los péptidos fueron sintetizados en el laboratorio de Síntesis de péptidos del Instituto de Medicina Tropical por el método de fase sólida (F-moc) descrito por (Merrifield, 1963). Los péptidos corresponden a la secuencia de aminoácidos de la segunda asa extracelular del receptor β1 adrenérgico humano (Mijares et al., 1996), cuya secuencia fue confirmada por espectrometría de masas en Acuapeptide síntesis, núcleo de Biotecnología (NBC), Chile.
Se ensayaron concentraciones del péptido (30μg/ml, 50μg/ml y 70 μg/ml) incubándose por 18 horas, dilución de los sueros (1/20, 1/50, 1/60), con un tiempo de incubación de 18 horas y dilución del conjugado (anti-IgG humano, acoplado a fosfatasa alcalina), con un tiempo de incubación de 90 min. Los ensayos se realizaron en placas de microtitulación de 96 pozos (maxisort, NUNC®), con sueros previamente diagnosticados por ELISA con antígeno total deslipidizado deepimastigotes de T. cruzi, por hemaglutinación indirecta, y que presentaran historia clínica de padecimientos cardiacos, escogiéndose 4sueros positivos: 1 de alta, 2 de media y 1 de baja reactividad, así como también 3 sueros negativos que corresponden a personas sanas sin antecedentes cardiacos y negativos a la ECh.
Para discriminar los sueros positivos de los negativos se determinó el punto de corte, mediante ensayo de 46 personas no cardiópatas sin antecedentes de contacto con triatominos. A partir de las lecturas obtenidas a través de un lector de micro placa ELISA (SpectraTecan) a una densidad óptica (DO) 405 nm, se calculó la media aritmética y la desviación estándar, y se definió el punto de corte como la media más 2 desviaciones estándar.
Se seleccionó como dilución óptima del conjugado aquella recta que muestra la máxima señal de reacción para cada una de las concentraciones empleadas donde se observó la mayor diferencia entre el suero positivo respecto al suero negativo correspondiente a una dilución del conjugado 1/500. La concentración óptima del péptido corresponde a una concentración de 50 µg/ml (figura 1).
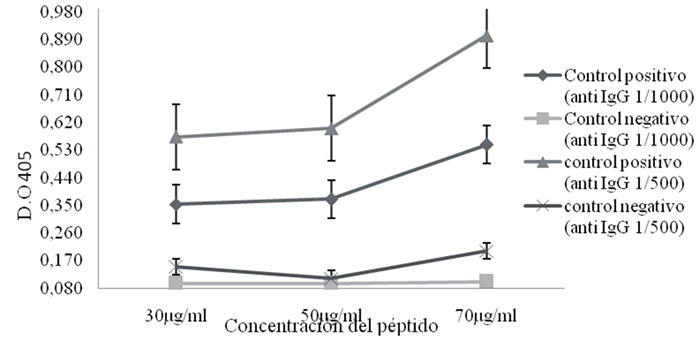
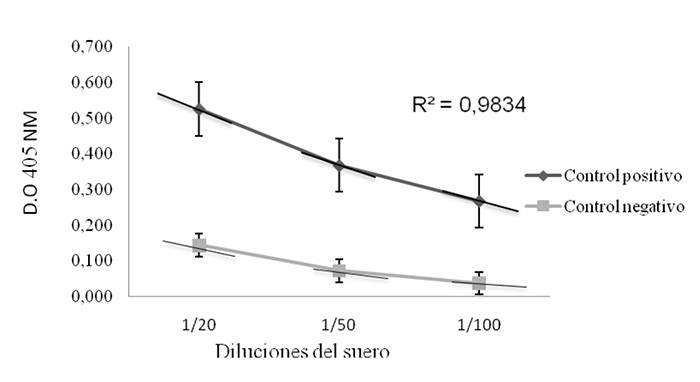
Se realizaron tres diluciones de los sueros controles positivos y negativos, en la cual la dilución óptima elegida fue 1/50 correspondiente al punto central de la curva con mayor pendiente, el coeficiente de determinación fue calculado dando un valor del R² ≥ 0,98 indicando que aproximadamente 98% de variación total de los valores en Y están relacionados con las variables X (Figura 2).
La estandarización de la prueba se resume en la tabla 1: concentración óptima del antígeno para ELISA fue de 50μg/ml, dilución del suero 1/50 y del conjugado 1/500. Estas condiciones, se ensayaron con 46 sueros negativos a fin determinar el punto de corte que se fijó en 0,278 nm D.O.
El detección de los anticuerpos β1 adrenérgicos se basa principalmente en pruebas serológicas como el ELISA, una técnica que se caracteriza por su precisión y exactitud, siendo relativamente simple con la ventaja de poder procesarse un número bajo o alto de muestras (Ochoa, 2012), un método relativamente simple que ha permitido establecer la alta prevalencia de estos anticuerpos en diversas enfermedades cardiacas (Goin et al., 1991; Chiale et al., 1996; Gimenez et al., 2002; Talvani et al., 2006; Calzada et al., 2009; Meiller et al., 2003). Existe poca bibliografía que respalde los procesos de estandarización del ELISA para la detección de los anticuerpos β1 son, sin embargo esto no le resta importancia al ensayo debido a su utilidad práctica. Se realizó la estandarización de cada uno de los componentes de la prueba estableciéndose las condiciones adecuadas para la detección de los anticuerpos anti-β1 adrenérgicos a través de la técnica ELISA como son establecidas por Ochoa, 2012 y Jacobson, 1998, empleando sueros controles con alta, media y baja reactividad donde se obtuvo como dilución óptima de los sueros 1/50, una concentración del antígeno de 50 µg/ml y del conjugado una dilución de 1/500, valores que coinciden con la metodología empleada por Magnusson et al., 1991.
Trabajos como los de Gimenez et al., 2002; Wallukat et al., 2000 y Calzada et al., 2009 han empleado la prueba ELISA para la detección de IgG específicos anti-receptor β1 adrenérgicos en suero de pacientes con ECh y otras cardiopatías, sin embargo, en ninguno de ellos se definen con claridad las condiciones de cada componente empleado en la técnica ELISA con el péptido β1 adrenérgico.
Al realizar una revisión bibliográfica se observa que trabajos realizados por Chiale et al., 1994; Talvani et al., 2006; Magnuson et al., 1991; Mijares et al., 1996, reportaron en la parte metodológica que emplean diferentes diluciones generalmente de 1/20 a 1/160 del suero de pacientes o animales infectados; pero con el objetivo de evaluar las diferencias entre positivos y negativos mas no para un proceso de estandarización.
Las concentraciones del antígeno empleadas también varían en cada uno de los estudios donde se emplean concentraciones que van de 0,5 µg/ml a 50 µg/ml Vicco et al., 2013; Mijares et al., 1996; Buvall et al., 2005; Talvani et al., 2006; Magnusson et al., 1991; Chiale et al., 1994), lo mismo sucede con el conjugado.
Chiale et al., 1994 sugiere que la validez de la prueba ELISA para la detección de los anticuerpos anti-β1 adrenérgico está sustentada por las similitudes en los resultados obtenidos en investigaciones realizadas en pacientes con diversas patologías cardiacas. Holthoff et al., 2012, indica que una alta variación de los porcentajes de estos anticuerpos evaluados en una misma enfermedad pueden deberse a la falta de una adecuada estandarización o si bien, puedan variar dependiendo de las zonas endémicas. Sin embargo, no se han realizado estudios bien diseñados en distintas poblaciones endémicas para demostrar esta hipótesis.
Podemos concluir que las condiciones evaluadas para la estandarización de la prueba ELISA en nuestro laboratorio, como sería la selección de concentración idónea del péptido y dilución óptima del suero y del conjugado resultaron apropiadas para la detección de los anticuerpos anti-β1 adrenérgicos en pacientes con Enfermedad de Chagas.
AGRADECIMIENTOS: a la Dra. Maria Angelita Lorenzo por la síntesis del péptido en laboratorio de Síntesis de péptidos del Instituto de Medicina Tropical y a la Dra. Fanny Guzman por la confirmación de la secuencia por espectrometría de masas en el Laboratorio de Biotecnología (NBC), Chile.