En los últimos 50 años, la peroxidación lipídica ha sido objeto de amplios estudios no sólo para elucidar los mecanismos patológicos sino también para aplicaciones clínicas prácticas como biomarcadores. La participación de los radicales libres como iniciador de esta reacción, hace que merezcan un tratamiento diferenciado. Aquí se presentan los aspectos conceptuales vinculados con los radicales libres, sus mecanismos de generación, así como el sistema de defensa antioxidante de que dispone el organismo para su protección. Se define el estrés oxidativo y se realiza una breve exposición del complejo mecanismo de la reacción de peroxidación in vivo de los ácidos grasos poliinsaturados (AGPI) que, actualmente, los estudios científicos la vinculan con las patologías crónico degenerativas como el cáncer, diabetes, enfermedades del sistema nervioso central y enfermedades cardiocerebro vasculares, entre otras.
Palabras clave: Peroxidación; estrés oxidativo; especies reactivas de oxigeno; enfermedades degenerativas.
In the past 50 years, lipid peroxidation has been studied extensively not only to elucidate the pathological mechanisms but also for practical clinical applications as biomarkers. The involvement of free radicals as an initiator of this reaction does that merit a differentiated treatment. Here the conceptual aspects related to free radical generating mechanisms and the antioxidant defense systems available to the body for protection are presented. Oxidative stress is defined and a brief description of the complex reaction mechanism peroxidation in vivo of polyunsaturated fatty acids (PUFAs), which currently scientific studies linked to chronic degenerative diseases such as cancer, diabetes, diseases is performed central, and cardio-vascular diseases brain nervous system, among others.
Key words: peroxidation, oxidative stress, reactive oxygen species, antioxidant.
Sección de Lipidología. Instituto de Medicina Experimental. Facultad de Medicina. Universidad Central de Venezuela. [email protected]
El aumento masivo de las expectativas de vida, ha originado un incremento relativo de las enfermedades crónicas y degenerativas asociadas a este; tales como la aterosclerosis, diabetes, cáncer, la degeneración de la mácula, enfermedades inflamatorias crónicas y enfermedades neurodegenerativas. Son diversos los factores que conducen a desencadenar y acelerar estas patologías, considerándose por lo tanto multifactoriales. Sin embargo, en los últimos años se han realizado numerosos estudios en individuos con enfermedades degenerativas, que sugieren una relación entre el metabolismo oxidativo celular con el deterioro funcional que implica el envejecimiento y numerosas alteraciones fisiopatológicas (Halliwell et al. 2006). Siendo el objetivo del presente trabajo , hacer una breve exposición de los conceptos básicos y antecedentes bibliográficos que resultan más importantes para el buen entendimiento del estrés oxidativo, la reacción de peroxidación lipídica y sus biomarcadores, que ofrecen una oportunidad única para investigar las diferentes enfermedades crónicas – degenerativas en la que podría estar involucrada dicha reacción
La formación de de radicales libres es un proceso normal e inevitable (Slater, 1984), ya que son producto de infinidad de reacciones químicas imprescindibles para la vida celular. Un radical libre (RL), se define como cualquier especie química, ya sea atómica o molecular, que posea uno o más electrones no apareados en sus orbitales más externos. Esta condición, los hace extremadamente reactivos y, tienen un tiempo de vida media muy corto, ya que tienden a estabilizarse cediendo o capturando electrones de otras moléculas del entorno, por lo que actúan como agentes reductores en el primer caso y oxidantes en el segundo (Slater, 1972).
In vivo, existe una amplia variedad de componentes de las células que producen reacciones de oxido reducción, en un medio acuoso, contribuyendo a la producción intracelular de las denominadas especies reactivas de oxigeno (EROs). La mayoría de las EROs que normalmente se producen en los sistemas biológicos provienen del metabolismo oxidativo mitocondrial, de la actividad de la enzima xantina oxidasa y en menor proporción de las autooxidaciones de catecolamina y hemoproteínas que ocurren en el citoplasma, membrana nuclear, retículo endoplásmico y peroxisomas (Freeman et al., 1982). Además, diariamente estamos expuestos a numerosas fuentes exógenas de RL; sustancias que son RL o que por procesos intracelulares de detoxicación generan RL. Estas sustancias provienen principalmente del humo del cigarrillo, contaminantes del aire, solventes orgánicos, pesticidas, herbicidas, y otras. La exposición de radiaciones electromagnéticas (rayos X y g) y de partículas (electrones, protones, fotones, y otras) también generan RL por transferencia de energía a componentes celulares como el agua (Machlin et al., 1987).
La reducción del oxígeno conduce a la formación del radical superóxido (O2•) (Freeman et al., 1982). La adición de un electrón al ión superóxido, resultará el ión peróxido, el cual se protona rápidamente en el ambiente celular para producir el peróxido de hidrógeno (H2O2) (1). Por lo tanto el peróxido de hidrógeno (H2O2) es un producto secundario de la autooxidación del superóxido, de forma espontánea o catalizada por la enzima superóxido dismutasa manganeso dependiente (Mn-SOD) especifica de la matriz mitocondrial (ecuación 1). También puede formarse directamente por la acción de varias oxidasas presentes en los lisosomas (Diplock. 1991).
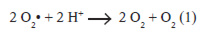
Es importante señalar, que el peróxido de hidrógeno no es un radical libre, pero en presencia de O2• y cationes de metales divalentes (hierro, o cobre), estos dos metabolitos pueden interaccionar y formar el radical hidroxil (•OH), uno de los oxidantes más fuertes de la naturaleza, e iniciador entre otras de la reacción de peroxidación de los lípidos en el organismo (Gutteridge et al., 1982).
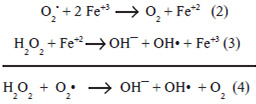
De forma análoga existen las especies reactivas derivadas del nitrógeno (ERN), que pueden ser o no RL (Figura 2). Entre estas, podemos citar los radicales libres óxido nítrico (NO•) y el dióxido de nitrógeno (NO2•), y entre las no radicales tenemos el catión nitronio (NO2 +) y el peroxinitrito (ONOO–), con alto poder oxidante (Radi, 2000).
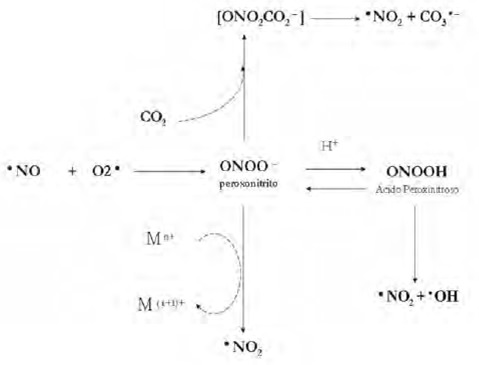
El NO• se forma endógenamente y tiene funciones fisiológicas importantes, pero su producción en exceso puede contribuir a la inflamación crónica y enfermedades cardiovasculares (Beckman et al., 1996). Además es un constituyente tóxico del humo del cigarrillo y polución del aire, y puede reaccionar con el oxígeno y generar una serie de compuestos de nitrógeno perjudiciales. Así tenemos el peroxinitrito (ONOO–), que se forma por la reacción del óxido nítrico (NO•) con el radical superóxido (O2•). Además el peroxinitrito (ONOO–), puede protonarse en condiciones fisiológicas, para formar el ácido peroxinitroso (ONOOH), poderoso agente oxidante y nitrante que puede dañar directamente proteínas, AN, lípidos. El ONOO– puede reaccionar con el CO2 formando el nitrosoperoxocarboxilato (ONO2CO2), ruta principal de reacción del peroxinitrito in vivo. Este aducto se descompone rápidamente a los radicales secundarios dióxido de nitrógeno (NO2 •) y carbonato (CO3 –) ambos poderosos agentes oxidantes (Wink et al. 1996; Beckman et al 1994). Finalmente, una pequeña fracción del peroxinitrito se homoliza, dando lugar a la formación del radical hidroxil (•OH).
Es importante resaltar, que tanto la forma aniónica como la protonada del peroxinitrito son capaces de atravesar, por diferentes mecanismos, biomembranas e iniciar la peroxidaciòn de lípidos como la oxidación de proteínas de membranas (Alvarez et al., 2003; Radi. 2000).
Sin embargo, no todas las ERO o ERN presentan la misma capacidad de reacción o son igual de reactivas. Ciertos compuestos como el peróxido de hidrógeno, el radical superóxido y el óxido nítrico, reaccionan de forma relativamente selectiva con sólo ciertas moléculas biológicas in vivo, mientras que el radical hidroxil es altamente reactivo, y reacciona instantáneamente con cualquier molécula próxima ocasionando daño oxidativo (Beckman et al., 1994).
La producción de ERO en condiciones fisiológicas se vuelve esencial para la vida manteniéndose un nivel basal, y están involucradas en numerosos mecanismos como la actividad bactericida de los fagocitos o la transducción de señales, la regulación del crecimiento celular o el estado rédox de la células, entre otros; pero una concentración elevada puede ocasionar daño oxidativo.
En este sentido, los seres aeróbicos, han desarrollado un mecanismo de defensa denominado sistema de defensa antioxidante que controla las concentraciones basales de ERO, que se generan continuamente como consecuencia del metabolismo aeróbico.
Moléculas antioxidantes endógenas y exógenas minimizan el daño oxidativo en los sistemas biológicos, previniendo la formación de EROs por la captura de estas especies antes que formen especies más reactivas y puedan reaccionar con las biomoléculas (Papas, 1996; Kohen, 2002) El mecanismo de inactivación de EROs incluye etapas sucesivas.
El proceso se inicia con la dismutación del radical superóxido a peróxido de hidrógeno bajo la acción de la superóxido dismutasa (SOD). Esta enzima está presente en el citosol (dependiente de Cu-Zn) y en la mitocondria (dependiente de Mn). Posteriormente la catalasa (CAT) y la glutation peroxidasa (GPX) catalizan la reacción de reducción del peróxido de hidrógeno en agua, siendo el equilibrio entre la catalasa y la SOD fundamental para lograr el equilibrio redox (Gutteridg, 1995; Céspedes et al., 1996).
La GPx es una proteína tetramérica que posee 4 átomos de selenio y necesita como sustrato esencial al glutatión. La GPx es un complejo enzimático, que se encarga de la reducción del peróxido de hidrógeno, generado por la SOD en agua, transformando el glutatión reducido (GSH) en glutatión disulfuro oxidado (GSSG). La glutatión reductasa regenera el GSH a partir del GSSG, transfiriendo los equivalentes reductores de la NADPH. (Cisneros et al., 1997).
Muchos antioxidantes extracelulares tales como proteínas (transferrina, lactoferrina, albúmina, ceruloplasmina) y urato previenen las reacciones de radicales libres secuestrando iones metálicos divalentes como el hierro (Fe+2 , Fe+3) y el cobre (Cu+1, Cu+2). Otros compuestos con capacidad antioxidante presentes en el organismo son la albúmina, el ácido úrico, la bilirrubina los cuales pueden secuestrar radicales libres directamente (Gutteridg, 1995), los estrógenos y la melatonina (Halliwell et al., 1986). El efecto antioxidante de la melatonina y los estrógenos depende tanto de su acción directa sobre las ERO y ERN, como de su capacidad para inducir la síntesis de enzimas antioxidantes. (Sirin et al., 2015).
Dentro de los antioxidantes exógenos, los cuales se incorporan al organismo a través de la dieta, se encuentran los tocoferoles, carotenoides, ácido ascórbico (vitamina C) (Machlin, 1987), flavonoides, polifenoles, tioles y otros (Davies ,1995).
Cuando en la célula ocurre un desequilibrio entre los agentes prooxidantes y sistemas antioxidantes, se genera un proceso conocido como estrés oxidativo, que es el producto combinado de una excesiva formación de ERO, una disminución en la eficacia de los sistemas antioxidantes endógenos, y una insuficiente incorporación dietaria de antioxidantes (Valko et al., 2007). En esta condición de estrés oxidativo, los radicales libres reaccionan con las principales macromoléculas de la célula, como son las proteínas, los lípidos, los carbohidratos y los ácidos nucleicos (ADN y ARN) dañando su estructura y su función biológica. De esta manera, el estrés oxidativo afecta considerablemente la célula, alterando diversos procesos bioquímicos que derivan en la activación del mecanismo de muerte celular programada, conocida también como apoptosis (Freeman.1982).
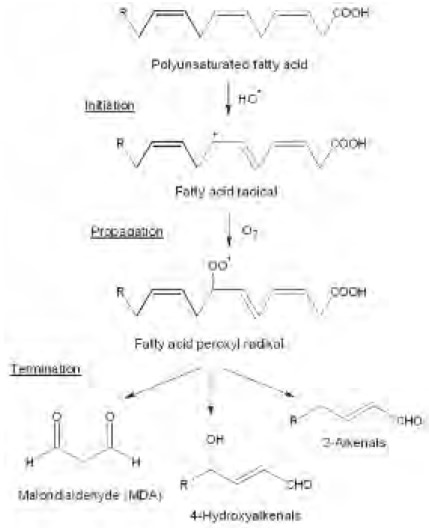
Los lípidos de las membranas biológicas y las lipoproteínas se encuentran entre los compuestos más vulnerables frente al ataque de las especies reactivas de oxígeno (EROs), reacción denominada peroxidación lipídica. (Wilhelm.1990; Gutteridge et al. 1990, 1995; Machclin et al. 1987). Los AGPI, constituyentes de los lípidos, son más susceptibles a peroxidarse, debido a que sus hidrógenos bis-alílicos son fácilmente “extraíbles” comparados con los hidrógenos alifáticos, una vez iniciado éste proceso prosigue como una reacción en cadena, involucrando las etapas de propagación, ramificación y terminación. (Halliwell. 1994).
Esta reacción es iniciada por el ataque del (OH•) un RL con suficiente reactividad para sustraer un átomo de hidrógeno del grupo metileno (-CH2-) unido a un carbono flanqueado por dobles enlaces de un AGPI en la posición S2 del fosfolípido.
Dado que un átomo de hidrógeno es un radical libre, ya que posee un electrón desapareado, su salida deja un electrón desapareado en el átomo de carbono del AGPI al cual estaba originalmente unido, formándose un radical del lípido (L•).
El radical libre del lípido formado en este paso de la reacción, es estabilizado por una reorganización de los enlaces (resonancia) que da lugar a la formación de un dieno conjugado del lípido.
En este paso del mecanismo de la reacción, el dieno conjugado del lípido, reacciona con el oxígeno y forma un radical peroxil del lípido (LOO•), el cual puede extraer un átomo de hidrogeno de otro AGPI adyacentes y originar un hidroperóxido del lípido (LOOH) y un nuevo radical libre de lípido (L•). Este nuevo RL de lípido puede reaccionar con oxígeno para formar otro radical peroxil del lípido (LOO•), constituyendo una propagación de la reacción de peroxidación, y el daño a un número creciente de lípidos. La extensión de esta etapa de propagación de la reacción, antes de la terminación depende de varios factores, entre ellos la concentración de RL, y la concentración de antioxidantes presentes.
La terminación de la peroxidación lipídica puede darse entonces por combinación de especies reactivas entre sí para formar productos no radicales o por reacción de estas especies con antioxidantes (Halliwell. 1990,1994).
Los hidroperóxidos (LOOH) productos primarios de la peroxidación, son moléculas bastante estables, pero su descomposición puede ser estimulada por metales divalentes (hierro y cobre). La descomposición de los hidroperóxidos genera una mezcla compleja de productos secundarios de peroxidación lipídica como hidrocarburos gaseosos (etano, pentano) y aldehídos como 4-hidroxi-2-nonenal (HNE), 4-hidroxi-2-hexenal (HHE) y malondialdehído (MDA) (Halliwell.1994). Los aldehídos más intensamente estudiados hasta ahora son el MDA, un dialdehído de tres carbonos altamente reactivo, generado como uno de los principales bioproductos de la peroxidación de AGPIs; y el HNE el principal aldehído formado durante la peroxidación de lípidos conteniendo AGPIn-6, tales como el ácido linoleico y ácido araquidónico. Estos aldehídos, pueden reaccionar con proteínas y ácidos nucleicos, lo que determina efectos citotóxicos, genotóxicos y mutagénicos, así como un papel patogénico en varias enfermedades (Sánchez, 2013).
La complejidad del proceso de la peroxidación lipídica aumenta con el número de insaturaciones que posee el AGPI. Así, cuando los radicales libres atacan al ácido araquidónico (con cuatro insaturaciones) (AA, C20: 4 w-6) unido a un fosfolípido, la abstracción inicial de un átomo de hidrógeno puede ocurrir en tres puntos de la cadena carbonada del AA, debido a que presenta tres grupos metileno (-CH2-) unidos a un carbono flanqueado por dobles enlaces, aumentando así la complejidad de la reacción de peroxidación. Figura Y:
La peroxidación del AA, genera tres radicales araquidonilo que forman a su vez cuatro endoperóxidos bicíclicos, los cuales se reducen a formas químicamente estables denominadas F2-isoprostanos (IsoPs) (Morrow et al. 1987).
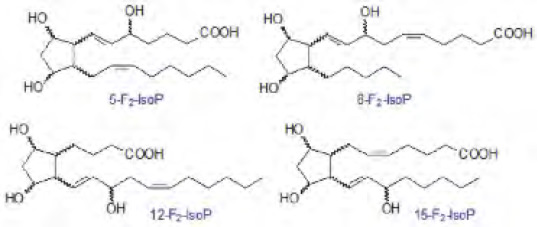
Cada molécula de IsoPs consta de ocho diastereoisómeros racémicos esterificados a fosfolípidos, que adquieren su forma libre por la acción de fosfolipasa A2, circulan en la sangre y eventualmente son excretados por la orina como compuestos metabolizados o no (Lynch et al. 1994). Las diferentes clases de diasteroisomeros se designan por el número del carbono en el que está situado el hidroxilo de la cadena lateral con respecto al carbono carboxilo designado como C-.1. De esta manera tenemos que la oxidación del ácido araquidónico (AA, C20: 4 w-6) produce cuatro series 5-, 8-, 12-, 15 – F2-IsoPs dependiendo de la localización de su grupo hidroxilo (Morrow et al. 1987).
El destino metabólico de los F2-IsoPs es en su mayoría es desconocido, excepto para 15 F2t-isoprostano (Practico, 1996). El 2,3 Dinor-5,6-dihidro-15-F2T-IsoPs es el principal metabolito en la orina del 15 F2T-IsoPs en los seres humanos.
Los ácidos grasos poliinsaturados de la serie n-3 (AGPI n-3) más importantes en la nutrición humana son el ácido graso eicosapentanoico (EPA, C20: 5 w-3) y el docosahexanoico (DHA, C22: 6 w-3), abundantes en las grasas y los aceites procedentes del pescado y otros animales marinos. Los efectos de los AGPI n-3 son muy amplios y abarcan el metabolismo de los lípidos y las lipoproteínas, acciones sobre la tensión arterial, la función cardiaca y el endotelio vascular, y propiedades antiagregantes y antiaterogénica, entre otras. (Katan et al. 1994, Giacopini et al. 2013).
Los AGPI n-3 forman parte estructural de las membranas celulares y tienen una función esencial en el desarrollo del tejido nervioso y en la retina (Hernández .2003).
EPA es un ácido graso altamente susceptible a peroxidarse, por presentar cinco dobles enlaces, y cuatro carbonos bisalílicos 7, 10, 13,16 donde puede ocurrir la abstracción de un átomo de hidrógeno por un RL. Se ha determinado que EPA genera seis clases de compuestos estructuralmente análogos a F2–IsoPs, pero con tres dobles enlaces (F3-IsoPs) Figura 5. Dependiendo de la posición donde ocurre la abstracción del átomo de hidrógeno y la unión del oxígeno, se forman ocho hidroperóxidos, que posteriormente generan seis regioisómeros, que se designan como 5-, 8-, 11-, 12-, 15- y 18-F3-IsoPs. (Figura 5). Teóricamente cada uno presenta ocho diastereómeros racémicos dando un total de 96 compuestos. Gao et al. 2006; proporcionó la primera evidencia de que los F3-IsoPs se generan in Vitro e in vivo.
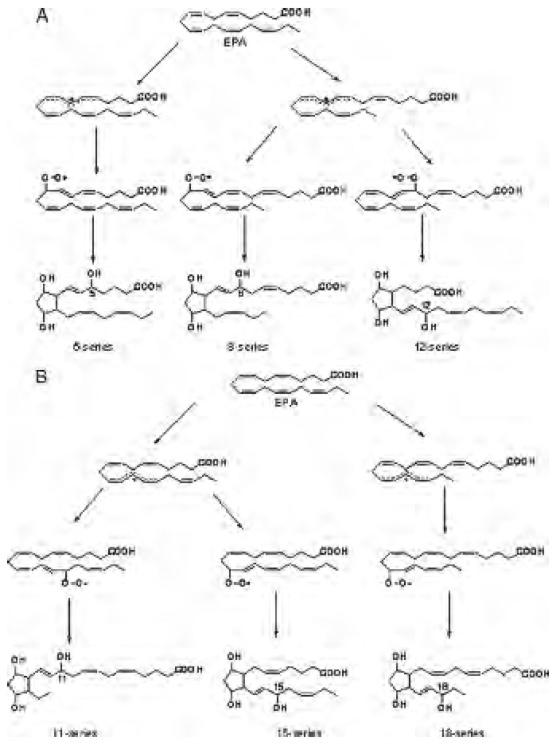
La peroxidación DHA n-3, conduce a la formación de compuestos similares a los IsoPs. Pero considerando que tales compuestos presentan una cadena carbonada con dos carbonos más que los IsoPs, no es posible denominarlos IsoPs.
Por lo tanto, considerando que las neuronas poseen una elevada concentración de DHA, estos compuestos se han denominado neuroprostanos (NSp), los cuales son considerados marcadores únicos de la lesión neuronal oxidativa. Al igual que los IsoPs, los intermediarios de los NSp son endoperóxidos bicíclicos, y se reducen a los F- anillos (F4-NSp). El DHA produce ocho clases de D4 isoprostanos, y ocho clases de E4 isoprostanos. Cada una de estas clases comprende una mezcla racemica de hasta ocho isomeros dando lugar a un gran número de compuestos. (Roberts et al.1998).
La formación in vivo de NSp se ha demostrado gracias a la utilización de la cromatografía de gases (C G) acoplada a la espectrometría de masas (SM), la cromatografía líquida (CL) y la técnica de ionización por electroespray (Electrospray ionization o ESI) utilizada en espectrometría de masas para producir iones (ESI-MS). Esta última técnica resultó ser particularmente importante para la caracterización y la cuantificación de las distintas series de NSp (Roberts et al.1998). Concentraciones post mortem ( 98 ± 26 ng / g de tejido cerebral) de A4 / J4-NPs se han determinado en la corteza parietal de cinco individuos sin daños neurológicos. Esta cantidad es cinco veces mayor en comparación con la detectada para neuroprostanes D4 / E4. Esto sugiere que la formación de neuroprostanos ciclopentanona representa la ruta preferida de la oxidación de los radicales de DHA. También se ha observado que un alto porcentaje de A4 / J4-NPs está esterificada a los fosfolípidos de membrana, lo cual podría esperarse que tengan efectos significativos en las propiedades biofísicas de las membranas neuronales, lo que podría alterar la función neuronal normal. Esto puede ser particularmente relevante, ya que se ha sugerido que una de las funciones fisiológicas de DHA puede ser mantener un cierto estado de fluidez de la membrana y promover las interacciones con proteínas de membrana que son óptimas para la función neuronal (Wilhelm, 1990).
Se han desarrollado numerosos métodos para hacer el seguimiento de la reacción de peroxidación lipídica o estrés oxidativo in vivo. En la actualidad es posible a través de la detección de biomarcadores como son los subproductos de la peroxidación lipídica: sustancias reactivas con el ácido tiobarbitúrico (TBARS), 4- hidroxinonenal, peróxidos lipídicos, etano, LDL oxidada, isoprostanos, neuroprostanos, o por la determinación de antioxidantes endógenos y la capacidad antioxidante.
Sin embargo, se ha establecido que la medición de F2-isoprostanos es el método más fiable para evaluar in vivo el estado de estrés oxidativo, proporcionando una herramienta importante para explorar el papel del estrés oxidativo y la peroxidación lipídica en la patogénesis de enfermedades (Lynch et al. 1994, Montuschi et al. 2004, 2007).
Los F2-isoprostanos se forman inicialmente en situ esterificado en los fosfolípidos, y luego son liberados por la acción de la fosfolipasa (Morrow et al. 1991). Por consiguiente los F2-isoprostanos pueden ser detectados en su forma esterificada en muestras de biopsias y de lipoproteínas del plasma, y en forma libre no metabolizada en fluidos tales como plasma y la orina. La medición del principal metabolito urinario del F2-isoprostano, 15 F2T-isoprostano, 2,3-dinor-5,6-dihidro-15-F2T-isoprostano, puede proporcionar una evaluación precisa de la producción endógena total de F2-isoprostano (Mothushi et al. 2004). La medición de F2-isoprostanos en los tejidos y/o fluidos biológicos proporciona un valioso nuevo enfoque para la cuantificación de estrés oxidativo, así como una base bioquímica para evaluar la intervención terapéutica.
La medición de los F2-isoprostanos presenta entre sus ventajas: que son químicamente estables, son productos específicos de la peroxidación lipídica que se forman in vivo y están presentes en cantidades detectables en todos los tejidos y fluidos biológicos normales, permitiendo así la definición de un rango normal. (Robert et al. 2000). Se ha determinado que la concentración de estos compuestos en el plasma y la orina de individuos normales se encuentran en un rango de 5 a 40 pg/mL y 500 a 4000 pg/mg de creatinina, respectivamente (Robert et al. 1998).
Igualmente se ha propuesto la cuantificación de los F4- NSP como un marcador único de la lesión oxidativa en el cerebro que podría ser utilizado como un método para investigar el papel de los radicales libres en la patogénesis de las enfermedades neurológicas (Miller et al. 2014).
La Teoría del Estrés Oxidativo trata del origen o causa de enfermedades crónicas-degenerativas. Son muchos los procesos patológicos donde está implicado el EO, así como múltiples los descubrimientos llevados a cabo por diferentes grupos de investigación, por ello sólo se harán unos breves comentarios de algunos de estos procesos patológicos más significativos relacionados específicamente con la peroxidación lipídica.
En las tres últimas décadas, gran cantidad de evidencias experimentales se han acumulado atribuyendo a los radicales libres y especialmente, a la peroxidación lipídica, un papel preponderante en la patogénesis de la aterosclerosis, debido a que las modificaciones estructurales que experimentan las LDL tras la acción oxidante de los radicales libres, pueden incrementar marcadamente sus características aterogénicas (Aviram.1993).
Los ácidos grasos poliinsaturados (AGPI) presentes en las LDL son especialmente sensibles a la oxidación (Giacopini et al. 2002). Su peroxidación lipídica presenta las mismas características generales descritas en los procesos oxidantes que ocurren en los lípidos de las membranas. La magnitud de estas reacciones puede estar limitada por diferentes factores, entre los que se encuentra el contenido de antioxidantes de las LDL (Esterbauer et al.1991).
Se ha demostrado que la peroxidación de los lípidos de las lipoproteínas de baja densidad provoca modificaciones en sus propiedades fisicoquímicas y biológicas. Las modificaciones detectadas son, aumento en la densidad, aumento de la movilidad electrofóretica, fragmentación de la apolipoproteína B 100, disminución en el contenido de fosfatidilcolina, aumento de lisofosfatidilcolina y otros. (Steinbrecher et al.1990). Entre los cambios fisicoquímicos de la LDL tenemos alteración de la composición de lípidos, así como cambio en la conformación de la lipoproteína. (Aviram, 1993).
Entre las evidencias de la contribución de la peroxidación de los lípidos en la patogénesis de la ateroesclerosis tenemos el hallazgo de LDLs oxidadas, peróxidos de lípidos y cantidades elevadas de sustancias provenientes de la descomposición de los hidroperóxidos, detectadas por el método del ácido tiobarbitúrico (TBARS) en áreas de la placa ateromatosa (Wilhelm. 1990) (Steinbrecher et al.1990); e inhibición de la oxidación de la LDL y retardo del progreso de la placa ateromatosa por terapias antioxidantes (Mao et al.1991; Esterbauer et al.1991; Céspedes et al. 2000).
Según la teoría oxidativa de la ateroesclerosis, un elevado número de partículas de LDL en circulación conduce a un aumento de velocidad de entrada de las LDL a la pared arterial, donde queda atrapada (Cromwell et al., 2004) (Osterud. 2003).
Aquí, en el espacio subendotelial, las LDL son modificadas por la peroxidación de los ácidos grasos poliinsaturados esterificados en la posición 2 de los fosfolípidos de la LDL). Las LDL oxidadas no constituyen un grupo simple y homogéneo de partículas, sino que este está formado por las diferentes partículas de LDL oxidada que se forman en el proceso. En términos bioquímicos, tenemos la partícula de LDL minimamente oxidada, una partícula en la cual la peroxidación lipídica está en una fase inicial y no afecta a la apo B, que está intacta, mientras que en las LDL completamente oxidadas la peroxidación lipídica se ha extendido a toda la partícula y se acompaña de modificaciones en la apo B. Las LDL minimamente modificadas inducen la expresión de la proteína- 1 quimiotáctica de monocitos (MCP-1), y el factor de estimulación de colonias de monocitos (M-CSF) de células endoteliales, (Gerrity et al., 1990) e inician el reclutamiento de los monocitos y promueven la diferenciación de los monocitos en macrófagos residentes (Cushing, 1990.),
Además, durante la peroxidación de los AGPI de la LDL, se generan hidroperóxidos del lípido, los que se descompone en cetonas y aldehídos como el malondialdehído o el 4- hidroxinonenal. Estos productos interaccionan con la apoliproteína B, en la superficie de la LDL, modificando específicamente el residuo lisina y disminuyendo la carga positiva de apo B, decreciendo su afinidad por el receptor LDL y aumentando su afinidad por el receptor recolector LDLox o acetil receptor de los macrófagos (Jessup.1986; Brown, 1983). Las LDL oxi son reconocidas por el receptor recolector en los macrófagos y son internalizadas. Este receptor a diferencia del receptor LDL, no es controlado por el colesterol celular, ocurriendo una captación incontrolada de la LDLox., acumulación de colesterol en los macrófagos, y la formación de células espumosas, paso inicial de la formación de la placa ateromatosa (Figura 2).
La peroxidación lipídica de los AGPI se asocia con efectos patogénicos, sin embargo estudios recientes señalan que EPA oxidado, inhibe significativamente la adhesión de monocitos a las células endoteliales (Sethi et al., 2002). Igualmente, se demostró que varios aldehídos, productos de oxidación no enzimática de EPA y DHA disminuye la expresión del receptor de CD36 en macrófagos humanos (Yamada et al., 2008). Esta regulación de CD36 por los productos de peroxidación de los AGPIn-3 en las células implicadas en la iniciación y progresión de la aterogénesis y la inflamación, abre nuevas líneas de investigación sobre los posibles efectos beneficiosos de la peroxidación lipídica de los AGPI n-3 (Vallve et al, 2002).
Las células cancerosas generan ERO que resultan de la disfunción mitocondrial, la estimulación de oncogenes, metabolismo anormal, y las actividades inflamatorias agravados. La evidencia disponible sugiere también que las células cancerosas dependen del nivel de ROS intrínseca para la proliferación y la supervivencia. Ambas funciones fisiológicas y fisiopatológicas se han atribuido a las ERO que provocan la peroxidación de lípidos.
Omotayo et al. 2013, realizó recientemente una extensa revisión sobre las evidencias, que asocian el estrés oxidativo y la peroxidación de lípidos con la progresión del cáncer, y los resultados indican claramente que la concentración plasmática de biomarcadores de peroxidación lipídica como el MDA e IsoPs se encuentra elevada en la mayoría de los individuos con cáncer de pulmón, cáncer de mama, cáncer de colon, cáncer de próstata, gástrico y otros. Estos trabajos indican claramente de que ERO y la peroxidación de lípidos está implicada en la progresión del cáncer. Igualmente se muestra que productos de peroxidación de lípidos ejercen efecto antitumoral y también potencian la citotoxicidad de los medicamentos contra el cáncer y la radioterapia (Stoll, 2002; Chajès et al. 1995). Este efecto sinérgico fue marcadamente inhibido por antioxidantes o inhibidores de la peroxidación de lípidos, corroborándose así la acción de los productos de peroxidación de lípido. Esto sugiere que los biomarcadores de la peroxidación lipídica pueden ser una herramienta de diagnóstico para predecir la probabilidad de recurrencia del cáncer y ser usado para monitorear el progreso o la eficacia de terapias en pacientes con esta patología.
Numerosos estudios han demostrado la abundante presencia de productos derivados de la peroxidación lipídica en la sangre y tejidos de los sujetos diabéticos (Clapes et al. 2001). En la diabetes se produce aumento de la producción de ERO y ERN, como consecuencia de la hiperglucemia crónica que manifiestan los individuos afectados por esta enfermedad metabólica. Así, las ERO y ERN producen peroxidación lipídica que afectan a diferentes tejidos y órganos del organismo del diabético y contribuyen a la aparición de la retinopatía (Hernández et al. 2011), la nefropatía (Ejalde. 2001)y la neuropatía diabéticas, entre otras (Brownlee et al. 2001).
El aumento de la peroxidación lipídica observado en los diabéticos, no solo está únicamente relacionado con la aceleración en la producción de ERO, sino también con un incremento ERN, y con la disminución de la defensa antioxidante, entre las que se incluyen el GSH, y todas las enzimas antioxidantes, (Giugliano et al. 1995; Diaz. 2006).
La hiperglucemia estimula la producción de ERO en la mitocondria, con activación del factor de necrosis Kappa beta (NFKappabeta), alterándose el cociente de óxido-reducción de la célula, con caída del NADPH oxidasa (Ramos, 2006). Los enzimas antioxidantes catalasa y glutatión reductasa que controlan la concentración de ERO, tienen como cofactor enzimático al NADPH,H+, por lo que la disminución de este último provocaría también una inhibición de la actividad de estas enzimas. (Céspedes. 1996; Cisneros. 1995). Esto a su vez produciría la caída en las concentraciones intracelulares de GSH y un aumento en los niveles de H2O2 y sus productos de oxidación.
Estudio de las causas implicadas en la aparición de enfermedades que cursan con la diabetes, demuestran que altos niveles de glucosa característicos de esta patología, inducen la glicosilación no enzimática de proteínas, la cual puede generar directamente la producción de anión superóxido (O2.-), en cantidades suficientes como para desencadenar in vitro la peroxidación lipídica (Mullakay et al, 1990; Diaz D. 2006).
Son muy extensos los trabajos que relacionan la importancia del estrés oxidativo / nitrooxidativo en el inicio y progresión de las enfermedades neurodegenerativas como Alzheimer (EA), Parkinson (EP), esclerosis lateral amiotrófica (ELA), Huntington (HD) entre otras (Halliwell. 2006; Chisten, 2000).
El sistema nervioso central por sus características bioquímicas y citológicos lo lo convierten en un tejido vulnerable a la acción de numerosos agentes citotóxicos. El cerebro es el órgano más susceptible al daño oxidativo debido al alto consumo de oxígeno, los bajos niveles de enzimas antioxidantes (catalasa y glutatión peroxidasa), altas concentraciones de hierro, que actúa como catalizador para la formación del radical hidroxil, y su capacidad como oxidante. El incremento excesivo de especies reactivas produce una respuesta inflamatoria crónica, excitotoxicidad por los metabolitos generados, y disfunción mitocondrial (López et al. 2014).
Las neuronas son particularmente vulnerables al ataque de los RL y la peroxidación lipídica por su alta concentración de AGPI n-3 y AGPI n-6 y producen como señalamos una serie de productos secundarios responsables de grandes daños celulares. La peroxidación de los lípidos de membrana afecta la homeostasis neuronal que produce un aumento en la rigidez de la membrana, disminución de la actividad de las enzimas unidas a la membrana, la destrucción de los receptores de membrana, y el cambio de permeabilidad (Wong-Ekkabut et al 2007; Olanow, 1993)
Se ha observado que las neuronas dopaminérgicas son especialmente sensibles al estrés oxidativo, debido a su alta tasa metabólica de O2 y también a la oxidación de la dopamina (DA), ya sea por autooxidación o por la ruta metabólica de la mono amina oxidasa MAO .Muchos de los procesos implicados en el estrés oxidativo y el daño oxidativo en la EP, son las acciones de la monoamino oxidasa B (MAO-B), esencial para la conversión enzimático de la dopamina a peróxido de hidrógeno (López. 2008).
El papel del daño oxidativo inducido por radicales libres en la patogénesis de enfermedades neurodegenerativas ha sido definitivamente establecida (Galbusera et al. 2004). Entre las evidencias de la implicación de la peroxidación lipídica en las enfermedades neurodegenertivas tenemos estudios post mortem y experimentales donde se observó que existe un aumento de los marcadores de peroxidación lipídica, incluidas las sustancias reactivas al ácido tiobarbitúrico (TBARS), malonil-dialdehído (MDA), 4-hidroxi-2-nonenal (HNE) y algunos isoprostanos en muestras postmortem de substancia nigra procedentes de cerebros de individuos con EP (Butterfield et al. 2010) y con EA. (Jeanner, 1995; Lovell. 1995; Jiménez.2006).
Se han encontrado altas concentraciones de F2-IsoPs, los indicadores más precisos de estrés y específico para la peroxidación lipídica, en los tejidos del cerebro y fluidos corporales en numerosas enfermedades neurodegenerativas, incluyendo la Enfermedad de Alzheimer (Sultana et al. 2010), la Enfermedad de Parkinson (Farooqui et al.2011), la Enfermedad de Huntington (HD) (Sultana et al. 2013); (Montine et al. 1999), y la esclerosis lateral amiotrófica (ALS) (Mitsumoto et al.2008) Recientemente se ha descrito un incremento de los isoprostanos, biomarcador de peroxidación del AA por RL, en el Líquido Céfalo Raquídeo (LCR), en el plasma y la orina de pacientes con un deterioro cognitivo leve; se piensa que estas alteraciones están presentes antes del comienzo sintomático de la demencia (Practico et al, 2002).
El aumento de ERO obedecen en parte a que las enzimas antioxidantes, catalasa, glutatión peroxidasa, muestran actividad reducida en cerebros de individuos con EP y EA. Además, se ha observado en individuos con EP que el glutatión reducido (GSH) la molécula intracelular más importante en cuanto a la eliminación de hidroperóxidos en el cerebro, se encuentra disminuido en la substancia nigra, lo que ocasiona que disminuya la inactivación del peróxido de hidrogeno y aumente la formación de radicales hidroxilo (Dorado et al, 2004). Se considera que la disminución en los niveles de GSH puede ser un indicador temprano del proceso de la EP, ya que esto también se produce en la enfermedad presintomática de Parkinson. El GSH se pierde sólo de la sustancia nigra en la enfermedad de Parkinson y esta disminución no se observa en otras áreas del cerebro o en otras enfermedades neurodegenerativas que afectan a esta región. (Owen et al. 1996). Otra patología neurodegenerativa asociada al EO es la esclerosis lateral amiotrófica, en la cual se ha observado que individuos con esa patología presentan mutaciones en el gen de la CuZnSOD, mutación que ocasiona la acumulación de ERO, estrés oxidativo y peroxidación lipídica (Peterson. 2007).
El estudio del EO y la peroxidación lipídica en las enfermedades cardiovasculares, cáncer, diabetes, y la neurodegenerativas entre otras, ha proporcionado datos muy importantes sobre su mecanismo patogénico. Además, los biomarcadores de la peroxidación lipídica como los isoprostanos y neuroprostanos, a pesar de su costo y complejidad, representan actualmente una herramienta de gran utilidad para el diagnóstico y monitoreo del progreso o la eficacia de terapias en pacientes con patologías posiblemente asociadas al EO y peroxidación lipídica.