Sección de Lipidología, Instituto de Medicina Experimental, Facultad de Medicina, Universidad Central de Venezuela.
[email protected]
Las lipoproteínas de baja densidad (LDL) son heterogéneas con respecto a su tamaño, densidad y composición lipídica. Entre las partículas de LDL, las más pequeñas y densas (LDLpd) son más aterogénicas y el fenotipo LDLpd está fuertemente asociado con el desarrollo de la enfermedad coronaria. Aquí revisamos recientes estudios sobre la subclase LDLpd y la importancia de su determinación.
Palabras Claves: LDL pequeña y densa. Fenotipo aterogénico. Enfermedad arteria coronaria.
Low density lipoprotein (LDL) particles are heterogeneous with respect to their size, density and lipid composition. Among LDL particles, the smaller and denser LDL particles (sdLDL) are more aterogenic and the sdLDL phenotype is strongly associated with development of coronary heart disease. Here we will review recent studies involving sdLDL subclass and the importance of measurement of sdLDL.
Keywords: Small dense LDL. Atherogenic lipoprotein phenotype. Coronary heart diseases.
La La Organización Mundial de la Salud (OMS), afirma que las enfermedades cardiovasculares (ECV) causan más de 17 millones de muerte en el mundo cada año y representan un tercio de todas las muertes en todo el mundo. Las ECV no sólo son la principal causa de muerte y discapacidad en los países desarrollados, sino también en países en vías de desarrollo. (OMS. 2010)
Por muchas décadas se ha aceptado que el riesgo de ECV, puede ser estimado por la concentración de triglicéridos totales (TG), colesterol total (CT), y particularmente colesterol asociado a las lipoproteínas de baja densidad (LDL- C) en el plasma. (Castelli y col.1986).
Sin embargo, numerosas investigaciones indican que existe una considerable proporción de pacientes con ECV, con concentraciones LDL-C dentro de los rangos de concentración recomendados. Esto es atribuible, a que su determinación no provee información sobre su heterogeneidad y aterogenicidad.
A continuación, trataremos algunos aspectos relacionados con la subclase de LDL más aterogénica, la LDL pequeña y densa (LDLpd) y la importancia de su determinación.
Las LDL comprenden distintas subclases de partículas que difieren en tamaño, densidad, composición, función metabólica y capacidad aterogénica. Mediante la aplicación combinada de las técnicas de ultracentrifugación sucesiva (Gofman y col; 1949), gradiente de densidad (Kraus y col. 1982), y electroforesis en geles de gradientes (EGPA) (Griffin y col.1990), se han aislado del plasma de individuos normales varias subclases de LDL (Havel y col; 1955). Éstas han sido clasificadas en base a su densidad y tamaño de la partícula en cuatro subclases principales designadas como: LDLI (1,022 – 1,032 g/mL) – LDLII (1,032 – 1,038 g/mL) – LDLIII (1,038 – 1,050 g/mL) y en casos de hipertrigliceridemia severa se observa una subclase muy pequeña y densa LDL IV (1,050 – 1,063 g/mL.), haciéndose más pequeñas con el aumento de la densidad (Austin y col. 1988). El tamaño de las LDL humanas presenta una distribución bimodal que dan lugar a dos fenotipo, uno de LDL pequeño y densa (LDL –III) y otro de grandes y menos densas (LDL-I y LDL-II). Estos fenotipos fueron denominados patrón A y B. El patrón B constituido por partículas LDLpd, menores de 258 A°; y el patrón A por las LDL mayores a 258 A° (Tabla 1).
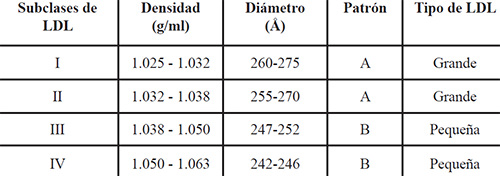
El patrón A, está presente en sujetos con concentraciones de triglicéridos menores a 0.5 m.mol/L (<44 mg/dL) mientras el patrón B se encuentra en individuos cuya concentración de TG excede los 2.0 m.mol/L (> 177mg/dL) (Austin y col.1990).
La concentración de las LDLpd permanecen debajo de 100 mg/dL hasta que la concentración de TG alcanza 1.5 mmoles/L (134 mg/dL) (Griffin y col.1994).
El predominio de LDLpd (patrón B) está determinado por factores genéticos, y no genéticos, entre los que cabe citar la obesidad abdominal, los hormonales y nutricionales, que pueden influir en la expresión de este fenotipo. (Austin y col. 1993; Silliman y col. 1994)
El fenotipo de las LDLpd, está determinado en parte por factores genéticos, con una heredabilidad que varía entre el 35 y el 45%. El predominio de las LDLpd se encuentra en conjunción con alteraciones familiares del metabolismo lipídico, que están asociadas a un riesgo aumentado de enfermedad cardíaca coronaria prematura, como hiperlipemia combinada, hiper-beta-lipoproteinemia e hipo-alfa-lipoproteinemia (Berneis y col. 2002)
Austin y col 1993, demostraron que la prevalencia del fenotipo B es aproximadamente del 30% en hombres adultos; del 5 al 10% en hombres y mujeres jóvenes (<20 años), y del 15 al 25% en mujeres posmenopáusicas. Estudios de familias con hiperlipemia combinada revelaron que el patrón B está íntimamente ligado a la presencia de concentraciones elevadas de triglicéridos.
Existen evidencias, que indican que el patrón B, o altas concentraciones de LDLpd es muy común en sujetos con resistencia a la insulina o con diabetes Millitus no dependientes de insulina. Esta asociación entre predominio de las LDL pd (patrón B) y la resistencia la insulina se debe a la concentración elevada de TG en plasma. (Tan y col; 1995).
El contenido de grasa y el tipo de ácidos grasos de la dieta pueden modular el diámetro y densidad de las partículas de LDL, y pueden influir en la expresión del fenotipo B (LDLpd). Estudios realizados por Krause y col. (1995), indicaron que la ingesta de dietas bajas en grasa provoca en una proporción significativa de individuos (41%) un cambio de patrón A (LDL grande) a patrón B (LDLpd). Por el contrario, ninguno de los participantes en el estudio con patrón B experimentó cambio al patrón A.
También se ha observado que el consumo de aceites parcialmente hidrogenados con un alto contenido de ácidos grasos trans, reducen la concentración de HDL-C, y elevan la de triglicéridos en plasma, condiciones que se asocian con la resistencia a la insulina, LDLpd , y aumenta el riesgo de ECV (Mensink y col. 1990; Caggiula y col .1997; Mauger y col. 2003; Kim y col. 2005; Giacopini MI. 2008).
A diferencia de estos ácidos grasos, se ha encontrado que el consumo de los ácidos ω3 eicosapentanoico (EPA) o docosahexanoico (DHA) disminuye la concentración de TG, y conduce a la formación de LDL grande y poco densa. Lo cual posiblemente es debido a que este ácido graso potencia en menor grado la actividad de la proteína de transferencia de los ésteres de colesterol (Davidson. 2006).Un estudio reciente en individuos con SM, indica que un consumo por 3 meses de 1,8 g/día de EPA purificado, disminuye la concentración de LDLpd en individuos con SM. (Satoh y col. 2007). Por consiguiente, el fenotipo de LDL puede ser significativamente modificado por la cantidad y calidad de las grasas de la dieta.
Aunque históricamente se ha considerado el aumento de la concentración de LDL-c como un factor de riesgo cardiovascular, el tamaño de la LDL emerge como un nuevo e importante factor de riesgo para estas enfermedades. (Austin y col. 1988; Gardner y col. 1996; Lamarche y col. 1997). Aunque el mecanismo no ha sido bien dilucidado, existen evidencias que indican que las LDLpd son más susceptibles a oxidarse e incrementan el riesgo a enfermedad cardiovascular más que las LDL grandes y poco densas (Tribble y col. 2001). Así, entre los múltiples mecanismos que pueden contribuir a una mayor aterogenicidad de las partículas de LDLpd respecto a las de mayor tamaño y menor densidad tenemos:
Nigon y col; 1995, señalaron que la subclase de LDL grande y poco densa tiene una mayor afinidad por el receptor de LDL celular que la subclase de LDL pd, y es degradada a una mayor velocidad.
Una explicación de este hecho es que la conformación de ApoB100 ubicada en la superficie de la LDL, y esencial para la unión de las partículas de LDL a su receptor celular, y degradación, depende del tamaño de la LDL (Baumstark y col. 1990). Cuando la LDL es pequeña y densa, apo B posee una conformación, que disminuye su afinidad por el receptor de LDL celular con respecto a las LDL más grandes. Por ende, las LDLpd permanecen en el plasma un mayor período de tiempo, teniendo así mayor oportunidad de infiltrar el endotelio vascular y modificarse por oxidación. (Tanfani y col.1997).
Estudios recientes consideran que una importante manifestación de la heterogeneidad de la LDL, es la variabilidad en el número de partículas de LDL entre individuos con la misma concentración de colesterol. Ellos pueden tener más alto o más bajo número de partículas de LDL en el plasma, y como consecuencia diferir en el riesgo de ECV. (Cromwell y col. 2004).
Considerando que cada partícula de LDL contiene una molécula de apo B, y que las LDLpd transportan menos colesterol. Dos individuos con igual concentración de LDL-C, pero uno con predominantemente partículas de LDLpd (patrón B), requiere 70% más partículas de LDL para transportar la misma cantidad de colesterol que una persona con LDL grande (patrón A). (Otvos y col. 2002).
Por consiguiente individuos con patrón B (LDLpd), tiene mayor número de partículas pequeñas en circulación, lo cual aumenta la probabilidad de infiltrar el endotelio vascular, y modificarse por oxidación.
Es así que pacientes con concentraciones de LDL – C similares pero con partículas de LDLpd tienen mayor riesgo de ECV.
Se ha encontrado que la alta afinidad de la LDL por los proteoglicanos (PGs) medida in vitro se relaciona con manifestaciones clínicas de la ateroesclerosis (Lamarche y col. 1997).
Las LDLpd, con menor concentración en lípidos polares en la superficie y cargadas más positivamente que las LDL grandes, presentan una mayor afinidad por los PGs de la pared arterial (Hurt y col. 1990).
Una explicación de este hecho es que las LDLpd tenían menos núcleo no polar cubierto por la monocapa de fosfolípidos y colesterol y presentaban mayor afinidad entre los grupos sulfato de los glicosaminoglicanos (GAG), cargados negativamente, y las cargas positivas de los aminoácidos lisina y arginina de la apo B100. (Mc Namara y col.1996).
Esto sugirió que en las LDLpd, la conformación de apo B, provoca que la secuencia de los aminoácidos 3359-3367, que se une a los GAG, esté más junta y expuesta en la superficie de la proteína y por consiguiente aumenta la afinidad por los PGs. (Boren y col. 1997).
Así, las LDLpd tienden fácilmente a asocian a los PGs de la matriz extracelular de la íntima, formando complejos insolubles que son captados por los macrófagos, contribuyendo a la formación de las células espumosas. Además, esta interacción entre la LDLpd y el PG permitió sugerir que los PGs retienen a la LDL en la matriz extracelular, ambiente propicio que favorece la oxidación de la LDL. (Camejo y col. 1990).
Son numerosas las potenciales modificaciones de la LDL que podrían ocurrir in vivo, pero, son las modificaciones oxidativas de las LDL, las que parecen tener sustentación experimental más vigorosa en cuanto a su relevancia biológica (Aviram y col. 1993). La modificación oxidativa de la LDL ocurre principalmente dentro de microambientes de la íntima arterial (Streinbrecher y col. 1990).
In vivo, el proceso responsable de esta modificación es la peroxidación de los ácidos grasos poliinsaturados iniciada por los radicales libres. Esta modificación depende del contenido de ácidos grasos poliinsaturados (AGPI), y de la concentración de antioxidantes liposolubles de la LDL. (Babiy y col. 1990; Esterbauer y col. 1987.
La mayor susceptibilidad de oxidación que presentan las LDLpd (LDLIII); respecto a las grandes y menos densas (LDLI-LDLII) es consecuencia de su mayor concentración de ácido araquidónico (C20:4); respecto a la fracción de LDL grandes, ácido graso sensibles al ataque de los radicales libres. (Giacopini y col. 2002). Además, poseen una menor concentración de antioxidantes, ya que estos disminuyen con el tamaño de la LDL, lo que las hace menos resistentes a la oxidación. (Tribble y col. 2001).
Otra posible causa de la mayor susceptibilidad de oxidación de las LDLpd respecto a las LDL grande y menos densa, es atribuida a la diferencia en la conformación de apo B, lo cual posiblemente provoca diferencias en la exposición de los antioxidantes y AGPI en las subfracciones de LDL atacadas por los radicales libres durante el proceso de peroxidación lipídica. (De Graaf y col. 1991).
Considerando los mecanismos planteados, las LDLpd son lipoproteínas altamente aterogénicas. Estudios prospectivos han demostrado que un perfil de lipoproteínas donde predomina la subclase LDLpd, está asociado con aproximadamente un riesgo 3 veces mayor de ECV (Lamarche y col. 1997). El predominio de LDLpd ha sido aceptado como un factor de riesgo de enfermedades cardiovasculares (ECV) por el National Cholesterol Education Program Adult Treatment Panel III. (2001).
Una de las dificultades al tratar de determinar si las LDLpd son un predictor independiente del riesgo de enfermedad coronaria o meramente un marcador de otras anomalías lipídicas, es que la LDLpd está asociada con las concentraciones elevadas de triglicéridos y reducidas de colesterol de HDL, y resistencia a la insulina. Perfil lipídico característico del Síndrome Metabólico (SM), la diabetes mellitus, la hipertrigliceridemia de cualquier causa, y la insuficiencia renal crónica, entre otras. (Scott y col. 1997).
Análisis univariado de estudios epidemiológicos y clínicos, sobre la asociación del tamaño de la LDL con la ECV, indicaron que en la gran mayoría de los estudios existe una asociación del tamaño de la LDL con el riesgo de ECV. Mientras, pocos estudios indicaron por análisis multivariado, que el tamaño de la LDL sea un predictor independiente del riesgo de ECV, después de ajustar la concentración de TG, y de HDL, (Rizzo y col. 2006).
Por lo que el análisis de las subclases de lipoproteínas debe llevarse a cabo, para poder mejorar las evaluaciones del riesgo ECV,
La distribución de las diferentes subfracciones de LDL puede determinarse mediante diferentes técnicas de laboratorio, entre las cuales la electroforesis en gel de poliacrilamida según el método de Krauss y col (1982), y la ultracentrifugación en gradiente de densidades son las más representativas. Sin embargo estas técnicas consumen tiempo y no han sido adaptadas para evaluar un número grande de sujetos o pacientes.
Desde la década de los 90 se ha propuesto un enfoque diferente para el análisis de las subclases de lipoproteínas, basado en las diferencias de señales que producen partículas de lipoproteínas de diferentes tamaños cuando son analizadas mediante espectroscopia de Resonancia Magnética Nuclear de protones (1H-NMR) (Otvos y col,1991;Otvos y col, 1992; Otvos y col; 1996). La principal ventaja de este método radica en que no es necesaria la separación física de las clases y subclases y el análisis por 1H-RMN provee, en unos minutos, la información que sólo se obtiene en varios días por métodos tradicionales. Otvos y col. 1991, ha desarrollado un método que permite determinar no solo el patrón de lipoproteínas, sino también el número de partículas. Bajas concentraciones de las partículas de LDL se asocian con un menor número de eventos relacionados con la enfermedad cardiovascular equivalente a más bajos niveles de colesterol LDL (Cromwell y col. 2007).
La complejidad de los métodos hasta ahora señalados, y la limitación de su uso para determinar las LDLpd, ha ocasionado que se estime el riesgo cardiometabólico a través de otras variables como la concentración de triglicéridos, de apolipoproteína B y la de colesterol transportado por las lipoproteínas de alta densidad (HDL-C); proporcionando una aproximación indirecta del patrón B de las LDL.
Como señalamos, las mayor proporción de LDLpd se observa cuando tenemos alta concentración de triglicéridos >1.5 mmoles/L (>134 mg/dL) y concentración baja de colesterol HDL (< 40), lo cual permite estimar la presencia de LDLpd por la relación TG/HDL-C, con un punto de corte de 1.35. (Boizel y col. 2000).
Warner y col; 2002, demostraron que la relación apo B /LDL-C en plasma es un buen predictor del patrón B en individuos con diabetes tipo 2. Sin embargo, los resultados de Tallis y col, 1995 no coinciden con este hallazgo. Una posible explicación de esta discrepancia es que en individuos con concentraciones de triglicéridos altos (> 2 mmol/L), hay un mayor % de apo B en el plasma asociado a la VLDL en vez de la LDL. Por lo tanto, la relación apo B 100/LDL-C es únicamente un buen predictor del tamaño de la partícula de LDL cuando la concentración de triglicéridos en el plasma es < 2mmol/L. (Scheffer y col; 2005).
La presencia de obesidad, síndrome metabólico o insuficiencia renal crónica, son indicadores de la posible existencia de partículas de LDLpd.
Las partículas de LDL pequeñas y densas actualmente se reconocen como un marcador cardiometabólico, por lo tanto su detección en el plasma puede ser útil como factor predictivo y como pesquisa de las enfermedades relacionadas con el estilo de vida que parecen asociarse con la resistencia a la insulina.
En este sentido, la metodología de su determinación por 1H-RMN provee información que no es accesible por los análisis clínicos de lipoproteínas empleados en la actualidad. La precisión del método por 1H-RMN, diseñados con técnicas de calibración multivariable, es comparable a los métodos clínicos actualmente utilizados. La eficiencia con la cual puede ser generada la data de las subclases de lipoproteínas y otras variables, abre nuevas alternativas para el diagnóstico, prevención y tratamiento de la enfermedad cardio- cerebro- vascular (ECCV) y cardiometabólicas como la diabetes, la obesidad y el síndrome metabólico a nivel de la población general.